| Titel: | Beiträge zum chemischen Theil der Bleichkunst; von Professor Zenneck in Stuttgart. |
| Autor: | Ludwig Heinrich Zenneck [GND] |
| Fundstelle: | Band 76, Jahrgang 1840, Nr. CV., S. 433 |
| Download: | XML |
CV.
Beitraͤge zum chemischen Theil der
Bleichkunst; von Professor Zenneck in Stuttgart.
Mit Abbildungen auf Tab.
VI.
(Fortsezung und Beschluß von H. 5, S.
391.)
Zenneck's Beitraͤge zur Bleichkunst.
II. Versuche mit Hanf.
Der im Wasser geröstete Hanf sieht bekanntlich
weißlichgelb aus, während der Wiesen- oder Tauhanf eine schmuzigere bräunlich
graue Farbe hat. Woher kömmt dieser Unterschied und warum ist jener seiner schon
gegebenen hellern Farbe ungeachtet schwerer zu bleichen als lezterer? Kömmt dieses
und jenes von einer dabei eintretenden verschiedenen Modification der fetten und
harzigen Farbtheile her, oder von einer verschiedenen Wirkung der verschiedenen
Röstungsart (eine gleichförmige mit Oxyden und Salzen begabte Wassermasse, oder
reines stets wechselndesEs ist bekannt, daß Wasser in Verbindung mit Luft die leicht oxydirbaren
Metalle mehr angreift als bloßes Wasser, es könnte daher jenes auch bei der
Taubleiche die Farbstoffe eher zersezen. Wasser) auf die erdigen Theile des Hanfes? – Um hierüber einige
Aufklärung zu erhalten, wurden folgende vergleichende Versuche angestellt mit
a) Wasserhanf und Tauhanf.
1) 150 Gr. Wasserhanf (= A.) und eben so 150 Gr. Tauhanf
(= B.) wurden mit einer Aezlauge, die aus 10 Gr. reinem Aezkali und 5 Kubikz. Wasser bestund,
zusammengebracht, auf den warmen Ofen gestellt, öfters geschüttelt und nach ein paar
Tagen mit reinem Wasser ausgewaschen, bis alle kalische Reaction aufgehört
hatte.
Die Erfolge davon waren:
α) Die Auflösung der
Wasserhanftheile (von A.) sah stark gelb aus, die der
Tauhanftheile von (B.) aber bräunlichgelb. Als nun zu
den beiden Auflösungen verdünnte Schwefelsäure gesezt und die Niederschläge filtrirt
wurden, so war zwar die Farbe der beiden filtrirten Flüssigkeiten gleichmäßig
gelblich, aber die von A. ging schneller durchs Filter,
als die von B., der Niederschlag aus A. enthielt also weniger zähe
Theile, als der von B.
β) Der Niederschlag aus A. sah troken bräunlichgelb aus und betrug 3 Gr., der von B. hingegen war braun und wog 4,5 Gr. also mehr, wie schon nach 1) zu vermuthen war. Beide
Niederschläge verhielten sich aber beim Verbrennen in einer Glasröhre auf gleiche Art: ihr Rauch
roch nach verbranntem Fett und brachte keine Färbung bei feuchtem Curcumapapier
hervor; die kalischen Auszüge enthielten daher keinen Stikstoff, welcher beim Verbrennen Ammoniak
hätte erzeugen können.
γ) Der in Aezlauge behandelte HanfA. hatte dadurch seine gelbliche Farbe nur wenig
verändert, indem er kaum etwas weißlicher geworden, der Hanf
B. hingegen sah nach derselben Behandlung mehr aschgrau
als gelblichgrau und deutlich weißlicher aus, und hatte
also durch die Lauge mehr von seinem Farbstoffe verloren, in Uebereinstimmung mit
dem größern Gewicht seines Auszugs.
Eine Veränderung der beiden Hanfsorten in der Stärke ihrer
Faser, theils in Bezug auf ihren ursprünglichen Zustand, theils in
Vergleichung mit einander nach dieser Behandlung konnte nicht wahrgenommen
werden.
2) 150 Gr. Wasserhanf (A.) und eben so 150 Gr. Tauhanf
(B.) wurden mit 5 Kubikz. Weingeist von 30° Beck digerirt und
diese Digestion nach Abgießung der gefärbten Flüssigkeit mit weiterem Weingeist ein
paarmal wiederholt, bis die Färbung aufgehört hatte. Die Erscheinungen dabei waren
folgende:
α) Die geistige Auflösung aus I. sah deutlich gelb aus, doch weniger stark als die
kalische und sezte beim Erkalten weisliche Floken ab; die
Auflösung aus b. hingegen sezte zwar auch solche Floken
ab, sah aber weit weniger gefärbt aus.
β) Der abgedampfte trokene Auszug von A. wog 3,5 Gr. und hatte
eine bräunlichgelbe Farbe, der von B. aber 2 Gr. und
zeigte neben feiner bräunlichen Farbe noch eine grünliche. Beide Auszüge schmolzen
bei der Erhizung, und rochen beim Verbrennen nach Verbranntem Fett und etwas aromatisch, ohne Curcumapapier zu bräunen. Dieser
Behandlung zufolge enthielt also A. mehr harzige oder fettartige Theile
als B. und lezterer, wie es scheint, ein grünliches Harz, keiner von
beiden aber (wie schon die kalischen Auszüge gezeigt hatten) Stikstoff.
γ) Die beiden rükständigen Hanfsorten hatten sich
bei dieser Behandlung weder in ihrer Farbe, noch in der Stärke merklich verändert,
selbst nicht der Hanf B.Dieser hatte dadurch eher noch eine dunklere Farbe angenommen., der doch bei der kalischen Behandlung weislicher geworden war. Was daher
dem Hanf B. die bräunlichgraue Farbe ertheilt, muß ein
leichter in Aezkali als in Weingeist auflöslicher, und also ein Ulmin- oder
humusartiger Stoff seyn, und da A. zwar mit Weingeist mehr Extract als B. geliefert hatte, jedoch bei bloßer Digestion damit
nicht merklich weißer geworden war, so scheint seine gelbliche Färbung von einem harz- und fettartigen
Farbstoff herzurühren, der nur durch anhaltendes Kochen entfernt werden
kann.
3) Von den nach 1) mit Aezlauge behandelten rükständigen
zwei Hanfsorten wurden je 120 Gr. mit wässeriger Schwefelsäure, die aus 1/10 Kubikz.
concentrirter Schwefelsäure und 9/10 Kubikz. Wasser bestund, also von spec. Gew. =
1,141 war, zusammengebracht und nach einigen Tagen mit heißem Wasser
ausgewaschen.
α) Die erhaltenen sauren Flüssigkeiten waren fast nicht gefärbt, jedoch bei B. etwas grauer als bei A.
β) Die mit kohlensaurem Kali bewirkten Niederschläge waren bei beiden sehr unbedeutend, nicht
gefärbt, sondern weißlicht, und enthielten erdige Oxyde.
γ) Die rükständigen Hanfsorten sahen aber nach
dem Troknen beiderseits röthlich aus und hatten an Stärke entschieden verloren.
Die Farblosigkeit der schwefelsauren Lösungen und der Niederschläge zeigt an, daß die
Farben der beiden Hanfsorten nicht von einem gewissen Eisenoxydgehalt herrühren, und, da die Schwefelsäure bekanntlich die
organischen Stoffe mehr oder weniger röchet, so rührte die entstandene röthliche
Farbe der damit behandelten Haufe von dieser Säure her.
4) Bei ähnlicher Behandlung der (nach 2) mit Weingeist
vorher untersuchten Hanfsorten mit wässeriger
Schwefelsäure zeigten sich keine andern Erfolge.
b) Da die gelbliche Farbe, welche bei dem Wasserhanf durch die gewöhnlichen Bleichmittel so schwer
zu entfernen ist, nach den vorgehenden Versuchen (a. 1
u. 2) von einem harz- und fettartigen Stoff herzurühren schien, der sich in
Aezlauge und bloß erwärmtem Weingeist nur schwer auflöste; so wurden 100 Gr. von
noch unverändertem Wasserhanf
1) mit Schwefeläther digerirt – dieser lieferte
einen gelblichen Extract, der nach Fett roch, leicht schmolz und mit gelblichter
Flamme verbrannte. Er wog = 1 Gr. und löste sich in kochendem Alkohol und bestand in
einem Gemenge von Fett und Harz. Der zurükgebliebene Hanf hatte seine gebliche Farbe noch nicht
merklich verloren.
2) Alkohol von 30° B., womit der rükständige Hanf hierauf gekocht wurde,
färbte sich etwas gelblich, sezte einige weiße Floken ab (ohne Zweifel dieselbe
fettwachsartige Substanz, welche beim Kochen von Tauflachs mit Alkohol erhalten
wurde), und hinterließ beim Abdestilliren einen bräunlichen Extract = 3 Gr., der
sich mit heißem Wasser in eine graue harzartige und eine braune, bittere und
extractartige Substanz
trennte. Nach dieser Behandlung hatte der Hanf schon merklicher von seiner
gelblichen Farbe verloren.
3) Als der von seinem Alkohol befreite Hanf nun mit reinem Wasser geschüttelt und
eine halbe Stunde damit stehen gelassen wurde, so erschien dieses sehr trübe. Es
wurde daher dasselbe abgesondert, filtrirt und nach abermaligem Wasserzuguß diese
Behandlung so lange wiederholt, bis die Trübung des Wassers aufgehört hatte. Das im
Filter Zurükgebliebene sah schmuziggrau aus, war sehr schleimig, zähe und schien
eiweißartig zu seyn, getroknet = 1 Gr. und von grauer Farbe, färbte aber beim
Verbrennen Curcumapapier nicht braun und war also nur Pflanzenschleim. Das filtrirte Wasser (etwa zwei Schoppen) hinterließ beim
Abdunsten einen gelblichbraunen bittern Extract = 1 Gr. und der rükständige
ausgepreßte und an der Sonne getroknete Hanf hatte jezt seine gelbliche Farbe in
eine graulichweiße verwandelt.
4) Von diesem graulichweißen Hanf wurden nun 80 Gr. mit einer Auflösung von 2 Gr. reinem Aezkali in 9 Kubikz. Wasser (wie bei dem
Flachs 100 Gr.) 8 Tage lang verschlossen der Sonne ausgesezt, um ihm seine
graulichweiße Farbe zu nehmen. Das Aezkali hatte aber nur wenig von ihm aufgenommen,
so daß sich der Niederschlag mit Salzsäure kaum auf 1 Gr. belief, und der Hanf
zeigte nach seinem Troknen keine weiße Farbe, sondern eher wieder statt der
graulichen einen Stich ins Röthlichweiße, wie wenn die kalte
Aezlauge den Farbstoff wieder hätte hervortreten lassen.
5) Um dem Wasserhanf aber diese röthliche Farbe zu nehmen, kochte ich ihn mit Alkohol von 30° B.,
wusch ihn nach seiner Herausnahme aus dem Gefäß mit reinem Wasser aus und sammelte
sowohl den weißen fettigen Niederschlag aus dem Alkohol,
als auch den braunen geistig wässerigen Extract, der so
wenig als bei dem Tauhanf einen stikstoffartigen Körper enthielt. Der Hanf hatte
jezt zwar sein röthlichgelbes Aussehen verloren und ein mehr weißgraues erhalten; da
er jedoch noch lange nicht weiß aussah, so behandelte ich ihn noch einmal mit
Aezlauge auf folgende Weise:
6) Der mit Alkohol gekochte und ausgewaschene Hanf = 57 Gr. wurde mit 20 Gr. Aezkali in 4 Portionen je mit 6 Kubikz. Wasser, so daß
jede Auflösung gegen 3/10 Proc. Aezkali enthielt, so lange gekocht, bis seine Bleichung merklicher als früher wurde. Diese ward nun
auch wirklich bedeutender nach dem Auswaschen mit Wasser und die rükständige Lauge
zeigte sich sehr braun gefärbt, und gab auch mit Salzsäure einen hellbraunen
humusartigen Niederschlag.
c) Wasserhanf und eben so Tauhanf (75 Gr. von jedem) wurden mit 6 Kubikz. Alkohol (26° B.) und hierauf noch einmal mit 4 Kubikz. nach der
bei (I. B. Fig. 2) angegebenen Weise
abwechselnd gekocht, bis leine merkliche Färbung, noch ein Niederschlag nach
Abgießung der heißen Auflösung bei ihrer Erkältung mehr eintrat.
Der Wasserhanf lieferte aber alsdann einen dem Volumen
nach geschäzten kleineren Niederschlag als der Tauhanf
und zeigte also weniger Gehalt an weißem fettwachsartigen
Stoff als lezterer. Umgekehrt lieferte aber der Wasserhanf einen größern alkoholigen bräunlichgelben, harzigen Extract = 3 Gr. als der Tauhanf, der = 2 Gr.
dunkelbraun und in Wasser leicht auflöslich war. Es scheint also der fettwachsartige
Stoff mehr bei gleichzeitiger Einwirkung der Luft und des Wassers, als durch
lezteres allein zu entstehen, jedenfalls aber wahrscheinlich aus den harzigen
extractivenDa nach Extractionsversuchen mit ungeröstetem, der
Farbe nach dem Wasserflachs und dem Wasserhanf sehr ähnlich aussehendem Flachs, ein solcher sehr wenig fettwachsartigen
Stoff, aber desto mehr braunes Fett nebst Harz
enthält, so verwandelt sich wahrscheinlich solches Fett bei der
Wasserröstung in Harz, bei der Tauröstung aber in fettwachsartigen
Stoff. Theilen, da sich diese beim Wasserhanf noch in größerm Verhältniß zeigten,
als beim Tauhanf.
Bei dieser Behandlung mit 10 Kubikz. Alkohol hatten die beiden Hanfe übrigens an
Entfärbung nicht gewonnen, vielmehr sahen sie jezt schmuziger aus und zwar der
Wasserhanf röthlichgrauer und der Tauhanf dunkler aschgrau, auch zogen sie an der
Luft nach mehreren Tagen wieder Feuchtigkeit an, weil sich ihr Extractivstoff jezt
wahrscheinlich mehr an die Oberfläche gezogen hatte. Eine ähnliche, wenigstens
scheinbar nachtheilige Wirkung des Alkohol auf den Entfärbungsproceß zeigte sich
auch bei dem Wasserflachs (I. D.), indem dieses Reagens
auch hier den braunen Farbstoff statt ganz auszuziehen, zum Theil an die Oberfläche
zu bringen schien. Daß aber dieser scheinbare Nachtheil bei einem nachfolgenden
Gebrauch von Aezlauge aufgehoben werde, indem diese alsdann um so sicherer entfärbt,
erweist sich aus den Versuchen mit Tauflachs, der nach (I. A.
c.) zuerst mit Alkohol und dann mit Aezlauge gekocht worden war.
III. Versuche mit verschiedenen bei der
Behandlung von leinenen und wollenen Zeugen vorkommenden
Gegenstaͤnden.
a) Versuche, die Theorie der Bleichung mit Chlor betreffend.
Der gewöhnlich angenommenen Theorie der Bleichung mit Chlor zufolge zersezt das Chlor das Wasser, in welchem der
Bleichgegenstand liegt, in Wasserstoff- und
Sauerstoffgas, verbindet sich mit jenem zu Salzsäure und der Sauerstoff verbindet sich mit den
Farbstoffen des Gegenstandes. Wäre diese Theorie richtig, so müßte eine unmittelbare
Herbeiführung des Sauerstoffs zu den Bleichgegenständen vortheilhaft seyn, und
ich stellte daher auch in zwei Fläschchen mit Tauflachs, wovon das eine 10
Kubikzoll atmosphärische Luft mit 2 Kubikz. Wasser und das andere eben so viel
Sauerstoffgas und Wasser enthielt, vergleichende Versuche an. Die Resultate
waren jedoch zu wenig entscheidend, als daß sie ohne Wiederholung in größerem
Maaßstabe für oder gegen diese Theorie etwas beweisen könnten. Ich habe aber
dieser Theorie deßwegen nie sehr beigestimmt, weil bekanntlich diese Verwandlung
des Chlors durch Wasser in Salzsäure sehr langsam vor sich geht, die Bleichung
eines vegetabilischen Stoffes durch Chlor aber einen sehr raschen Gang befolgt.
Um übrigens noch meine Zuhörer von der Langsamkeit dieser
Chlorverwandlung in Salzsäure durch ein bestimmtes Experiment zu
überzeugen, schloß ich in ein Fläschchen von 5 Kubikzoll Inhalt frisch
bereitetes Chlorgas mit einem Kubikzoll Wasser luftdicht ein und stellte das
Gefäß in die Sonne. Nach zwei Wochen war aber die grünlichgelbe Farbe des Gases
noch darin sichtbar, und verschwand erst vollkommen nach ein paar Monaten.
Alsdann wurde das Fläschchen unter Wasser geöffnet; hiebei trat nun zwar über
die Hälfte des Gefäßinhalts Wasser ein und lezteres färbte alsbald Lakmuspapier
roth, aber das Fläschchen selbst roch noch sehr nach Chlor und das eingetretene
Wasser bleichte solches Papier noch augenbliklich vollkommen; es war also von
den 4–5 Kubikz. Chlorgas nur ein Theil in Salzsäure verwandelt, der
übrige Theil aber von dem eingeschlossenen Wasser absorbirt, jedoch nicht
verändert worden. Nun geht die Bleichung mit Chlor oder mit irgend einer
chlorhaltigen Flüssigkeit sonst immer weit rascher vor sich, als die auf irgend
eine andere Weise bewirkte. Es dürfte daher nicht unwahrscheinlich seyn, daß das
Chlor entweder unmittelbar
den Wasserstoff der Pflanzenfarben an sich
reißt, und dadurch die Bleichung hervorbringt, oder, daß es sich als Chlor oder als Salzsäure mit den Farbstoffen zu
leichten auflöslichen Körpern verbindet, besonders da
man weiß, daß Chlor den Schleim in Citronensäure und das Fett in Chlorwachs
verwandelt, das Stärkmehl sauer macht, und daß salzsaures Gas mit Terpenthinöhl
eine Art Kampher hervorbringt. Nur fragt es sich hier namentlich, was aus dem
gewöhnlich braunen Extract wird, den man bei
Behandlung des ungebleichten Flachses und Hanfes mit Alkohol und Lauge erhält?
In dieser Hinsicht wurden folgende Experimente angestellt.
1) Der dunkelbraune Extract einer Behandlung des
Flachses mit Alkohol und nachherigem Wasser, wurde im Wasser wieder bis auf eine
geringe unlösliche Portion aufgelöst und einem langsam sich entbindenden Strom von
Chlorgas ausgesezt. (Siehe Fig. 3). Nach ein paar
Stunden wurde der Extract hellbraun, dann
gelblichbraun und zulezt hell schwefelgelb. Beim
Abdampfen des herausgenommenen Gemenges von Flüssigem und Festem hörte die
Verflüchtigung von Chlor und Salzsäure bald auf, und auf dem Boden der Schale
erschienen bräunliche pulverartige Theile, während die Flüssigkeit dunkler gelb
wurde. Nach dem Filtriren zeigte der zurükgebliebene
Extrat keine saure Reaction, war nicht ganz in Wasser auflöslich und noch
weniger in Alkohol, hatte auch beim Eintroknen über Wasserdämpfen eine etwas
hellere Farbe angenommen als der ursprüngliche Extract; das Filtrat aber, das beim weitern Abdampfen dunklergelb
geworden und bei stärkerer Erhizung salzsaure Dämpfe ausstieß, auch mit
kohlensaurem Kali stark aufbrauste, hörte bei Wasserzusaz und abermaligem
Abdampfen auf, saure Dämpfe auszustoßen und wurde zulezt schmuzigweiß und im
Wasser, wie in Alkohol sehr wenig auflöslich. Sobald aber Schwefelsäure darauf
gegossen wurde, erschienen wieder saure Dämpfe, die mit ammoniakhaltigem Papier
weißlicht wurden und daher Salzsäure waren. Allen diesen Erscheinungen zufolge
hatte sich also der Extract mit dem Chlor oder der daraus entstandenen Salzsäure
verbunden und dadurch seine dunkle Farbe verloren; und da wenigstens der größere
Theil des Extracts seine Auflöslichkeit im Wasser und Alkohol verloren hatte, so
wurde er wahrscheinlich seiner Bestandtheile nach verändert.
2) Eine Auflösung der Häute von schwarzen Trauben in
Wasser, die dunkelrothbläulich aussah, wurde mit den noch schwarz aussehenden
Häuten einem langsamen Chlorgasstrom bei einer Vorrichtung (siehe Fig. 3)
ausgesezt, wobei das überflüssige Chlorgas in Ammoniak zersezt und ein anderes
zugleich etwa sich bildendes kohlenstoffhaltiges Gas entweder von dem Ammoniak
aufgenommen oder in einem mit Salzwasser angefüllten Meßcylinder aufgefaßt
werden konnte. Nach mehreren Stunden, während welchen das Ammoniak einiges
Chlorgas aufgenommen und statt dessen sein entsprechendes Stikgas in den
Meßcylinder hatte übergehen lassen, wurde die dunkelrothe Auflösung röthlichgelb und selbst ein großer Theil der Häute hatte
eine gelbliche Farbe angenommen.
a) Die röthlichgelbe
Auflösung reagirte während des Abdampfens, so lange sie noch viel
Wasser enthielt, zwar als Dampf nicht saurer; sobald sie aber dichter und
zugleich dunkler rothgelb, zulezt bis ins Schwarzbraune geworden war, fing sie
an Salzsäure zu entwikeln und zeigte diese ebenfalls
bei Aufguß von concentrirter Schwefelsäure durch weiße Dämpfe an, als ein
Stöpsel mit Ammoniak darüber gehalten wurde. Als nun zu einer Portion der
dunkelbraunen Flüssigkeit Ammoniak gegossen wurde, so gab sie zwar wieder weißlichte Dämpfe
(Salmiakdämpfe), aber die frühere dunkelrothe Farbe kehrte nicht wieder,
vielmehr wurde die Mischung nur hellbraun.
b) Bei den mehr oder weniger gelblich gewordenen Häuten war weder bei dem Eintroknen, noch bei Zuguß
von Schwefelsäure viel Salzsäuregehalt wahrzunehmen; als aber Ammoniak oder
Pottasche mit ihnen gemischt wurde, so nahmen sie alsbald ihre ursprünglich röthlichschwarze Farbe wieder an. Der Farbstoff war bei ihnen also nicht, wie bei dem durch
Wasser erhaltenen Auszug durch das Chlor vertilgt.
c) Ein kohlehaltiges Gas, als z.B. Kohlensäure oder
Kohlenwasserstoffgas, konnte weder in dem Ammoniakgefäß, noch in dem Meßcylinder
neben dem Stikgas aufgefunden werden.
Was daher der erste Versuch mit dem in dem Flachs vorkommenden braunen Farbstoff schon gelehrt hatte, daß nämlich sich
dieser jedenfalls mit dem Chlorgas (als Salzsäure) in
eine innige Verbindung sezt und durch diese Verbindung für das Auge mehr oder weniger
verschwindet, das zeigte auch hier der zweite Versuch, welcher mit einem
ausgezeichneten andern Farbstoff angestellt worden ist.
Ist aber diese Folgerung aus den angestellten Versuchen richtig, so ist weder die
(um mich kurz auszudrüken) Sauerstofftheorie (der Chlorwirkung durch den
Sauerstoff des Wassers auf die Farbstoffe), noch die Wasserstofftheorie, nach
der das Chlor den Wasserstoff der leztern an sich risse und sie dadurch
zerstörte, anzunehmen, sondern eher die Theorie einer unmittelbaren Verbindung
Eine solche unmittelbare Verbindung des Chlors mit einem Bleichgegenstand
will auch R. Kane durch Versuche gefunden
haben. (Siehe Buchner's Repert. d. Pharm. XIX. S. 108.)
mit dem Ganzen, oder vielleicht auch zum Theil veränderten Farbstoffe; und da diese
salzsaure Verbindung in Wasser nicht sehr löslich ist, so folgt daraus, daß
dieses nicht hinreicht, die Wirkungen dieser Verbindung, die dem
Bleichgegenstand bei längerem Aufenthalt schädlich seyn müssen, aufzuheben, und
daß zu ihrer Herausschaffung kräftigere Mittel, wie namentlich starke Lauge,
angewandt werden müssen.
b) Vergleichende Versuche mit verduͤnnter Schwefel- und
Salzsaͤure.
Um die erdigen Salze, besonders die Kalksalze aus der Leinwand bei der Bleichung
abzutrennen, hat man neuerdings Salzsäure
vorgeschlagen, statt
verdünnter Schwefelsäure, weil der salzsaure Kalk ungleich löslicher in Wasser
ist, als der Gyps, der bei solchem sauren Bad entstehen kann. Es fragt sich
aber, ob die Salzsäure die Leinwand nicht mehr als
die SchwefelsäureH. Kurrer (S. 26 und 156) empfiehlt zu 1000
Th. Wasser 10–12 Th. Schwefelsäure von 71° B. (die 65
Proc. reine Säure enthält) zu sezen. Die Stärke seiner Säure ist also =
1°,7 B. angreift und sie vielleicht nicht bei einem niederen Grad ihrer Stärke
weniger schädliche Folgen hat? – Die in der Hinsicht angestellten
Versuche mit schlesischer Leinwand waren folgende: je 5–6 Quadratzoll
davon wurden in 5 Kubikzoll sehr verdünnter Schwefelsäure und eben so von
Salzsäure zwei Tage lang eingetaucht erhalten. Die mit Beck's Säurearäometer gemessene Stärke der
Säure war bei
Nr. 1 = 1°
( = 10° des Essigaräometers.)
Nr. 2 = 1,5°
( =
15°
– )
Nr. 3 = 3,0°
( =
30°
– )
Die Leinwandstüke wurden vor dem sauren Bad mit heißem
Wasser ausgewaschen und eben so wiederum nach
demselben, so daß sich bei Auflegung von Lakmuspapier kaum noch eine Spur von
Säure bei ihm gezeigt hatte. Nach ihrer Troknung ergab sich bei der Prüfung des
Einflusses der angewandten Säuren Folgendes: das Bad von Nr. 1, sowohl das
salzsaure als das schwefelsaure, hatte die Faser nicht angegriffen, aber das von
Nr. 2 jedoch nur das salzsaure und kaum das schwefelsaure; stärker und
sichtlicher hingegen Nr. 3 von beiden Arten Säure. Aus diesen Versuchen folgt
also, daß zwar ein salzsaures Bad bei einem höhern
Grad der Stärke als 1° B. die Faser mehr
angreift, als ein schwefelsaures derselben Stärke, bei jenem Grad (1° B.) hingegen, und um so
weniger bei niedrigerem (nach dem Essigaräometer) der Faser nicht schädlich ist.
c) Untersuchung geschwefelter
Tuͤcher.
Nach Grotthuß (siehe Berzel. Lehrb. der Chem. I. S. 470) verbindet sich bei dem Schwefeln der Tücher die schwefliche Säure mit den
Farbstoffen zu weißlichter Materie; nach Andern aber bedekt nur der Schwefel die
Oberfläche der Tücher und diese Bleichweise ist jedenfalls so wenig dauerhaft,
daß wohl eine solidere zu wünschen wäre. Um darüber in beiderlei Hinsicht durch
eigene Versuche belehrt zu werden, kochte ich 1) ein Stük geschwefelten Flanells
mit Alkohol (25° B.); der geringe Rükstand des Auszugs = 1 Gr. roch aber
bei dem Verbrennen nicht schweflichsauer, und es war demnach kein Schwefel vom
Alkohol aufgelöst worden. 2) Ein anderes Stük von solchem Flanell, das mit Aezlauge kalt behandelt worden war, lieferte a) beim Ausdrüken eine trübe Lösung, die
eingetroknet mit Schwefelsäure zwar einen weißlichten Niederschlag, aber keinen
Geruch nach schweflicher Säure, noch nach Schwefelwasserstoff gab, und b) eine helle Lösung, die beim Aufgießen von
Schwefelsäure einen dem Schwefelwasserstoff ähnlichen widrigen Geruch erregte,
so daß die Aezlauge wenigstens keine schwefliche Säure aufgenommen zu haben
scheint. 3) Ein drittes größeres Stük desselben geschwefelten Flanells, gegen 10
Quadratzoll groß, wurde in einer Retorte mit reinem
Wasser (gegen 8 Kubikz) mehrere Stunden lang gekocht und die Vorlage
immer kalt erhalten; das übergegangene Wasser färbte nun Lakmuspapier roth und
roch auch nach Schwefelwasserstoffgas, während das zurükgebliebene Wasser der
Retorte keine Reaction zeigte; schwefliche Säure war also wohl schwerlich in dem
geschwefelten Flanell, sondern entweder Schwefelwasserstoffsäure oder Schwefel, der
das kochende Wasser zersezt und jene Säure erst gebildet hatte.
Diesen Versuchen zufolge scheint mir daher bei der Schwefelung der wollenen Zeuge
nicht sowohl eine Verbindung mit schweflicher Säure (wenigstens nicht als eine
bleibende Verbindung), sondern eher eine Bedekung mit
Schwefel Statt zu finden, der sich durch Zersezung der innern oder
äußern Feuchtigkeit mehr oder weniger in Schwefelwasserstoff verwandelt und
durch diesen die bekannte Schwärzung benachbarter Silberstoffe hervorbringt.
– Was aber die versuchte Herausschaffung des braunen Farbstoffs des
Flanells durch Alkohol oder kalte Aezlauge betrifft, so führte sie durchaus
nicht zum Ziel, da die auf diese Art behandelten Stüke insgesammt nach dem
Troknen schmuziger aussahen, als so lange sie der Schwefel noch bedekt
hatte.
d) Untersuchung der Weizenstarke in Vergleichung mit
Kartoffelstaͤrke.
Die Stärke des Weizenmehls
wird bekanntlich bei dem Stärken der Zeuge der des Kartoffelmehls vorgezogen, weil sie bei feuchter Luft nach ihrer
Anwendung mehr Haltbarkeit zeigt als leztere, und die Weber schreiben ihr daher,
im Gegensaz zu der Kartoffelstärke, mehr Leim zu. Es ist also nicht bloß
wichtig, ein sicheres Unterscheidungszeichen dieser
beiden Stärkearten zu haben, sondern es fragt sich auch, ob die Weizenstärke
wirklich einen gewissen leimartigen Stoff enthalte,
der sie bei ihrem Gebrauch gegen Erweichung der Zeuge durch die Feuchtigkeit der
Luft schüzt.
1) Zur Unterscheidung der Kartoffelstärke von der Weizenstärke hat nun vor
einigen Jahren Marozeau (Erdmann's Journ. der techn. Chemie XVI. H. 2)
angegeben, daß man 1 Quentchen der Stärke mit 1/2 Kubikz. concentrirter
Schwefelsäure mischen und dann noch 1/4 Kubikz. Wasser darauf gießen soll und
daß man alsdann bei der Kartoffelstärke einen ameisensäureähnlichen Geruch empfinden werde, während
er bei der Weizenstärke ausbleibe. Dieses Kennzeichen ist nach den von mir
angestellten mehrfachen ProbenHiebei zeigte sich die Mischung der Kartoffelstärke als durchscheinend
wasserhell, die der Weizenstärke aber als weißliche trübe. richtig; nur ist der bei der Kartoffelstärke eintretende Geruch nicht
sowohl ein ameisenartiger, sondern vielmehr ein faulichter Geruch, der
vielleicht von dem Fuselöhl der Kartoffeln herrühren konnte, und wenn Marozeau behauptet, daß man mit diesem Mittel selbst
noch 1/50 Kartoffelstärke, die mit Weizenstärke gemengt wäre, darin erkennen
könnte, so dürfte hier einige Uebertreibung Statt finden. Uebrigens ist der
Stoff, welcher der Kartoffelstärke diesen Geruch ertheilt, von der Art, daß man
ihn bei einer Destillation von verdünnter Salzsäure mit solcher Stärke in der
Vorlage erhält, und daß das erhaltene Destillat nicht sobald seinen Geruch
verliert.
2) Um zu finden, ob die Weizenstärke wirklich einen
gewissen leimartigen Stoff enthalte, kochte ich 1/2
Loth davon mit Alkohol von 0,85 spec. Gewicht über eine Stunde lang und
filtrirte das Gekochte noch siedend heiß; die filtrirte Flüssigkeit sah schmuzig gelblich aus und ließ bei dem Abdestilliren
einen honiggelben klebrigen Stoff zurük, der bei dem Verbrennen in einer
Glasröhre Curkumapapier durch seinen Rauch bräunte, wie der Pflanzenleim des
Klebers. Kartoffelstärke hingegen, die auf gleiche
Weise mit Alkohol gekocht ward, lieferte kein gelbliches
Filtrat, sondern nur ein weißlichtrübes, das, ohne beim Verbrennen
Curcuma zu bräunen, nur durch eine geringe Menge aufgelöster Stärke seine Farbe
erhalten hatte. Die bessere Beschaffenheit der Weizenstärke kömmt also
wahrscheinlich von dem Pflanzenleim her, als einem Klebertheil, welcher bei dem
Abschlämmen des Weizenmehls mit kaltem Wasser sich nicht ganz vollkommen
abtrennt.
Anhang:betreffend den Gebrauch des Gasometers (Fig. 5) bei
Pruͤfungen von fluͤssigen Chlorverbindungen
und aufgeloͤster Pottasche.
In Buchner's Repertorium XLV.
H. 2 (alte Folge) findet sich zwar eine Beschreibung meines pneumatischen
Chlorometers und Anleitungen zu seinem Gebrauch bei Prüfungen von Chlorkalk, von Säuren (als Acidometer),
von Salzen, die Kohlensäure enthalten (als Antracometer) etc. – Es ist aber
weder hier, noch in andern Journalen, wo dieses Instrument erklärt wird, das
Verfahren angegeben, nach welchem 1) ein bereits in Wasser aufgelöster Chlorkalk,
oder bloßes Chlorwasser, mit einem Wort: eine liquide
Chlorverbindung – 2) unter den kohlensauren Salzen, namentlich das
basisch kohlensaure Natron (Soda), sey es im festen oder aufgelösten liquiden
Zustand gegeben, geprüft werden kann. Nun kommt es aber nicht selten vor, daß man
wissen will, wie stark ein bereits gebrauchtes Chlorwasser noch ist, um zur
Bleichung eines weitern Gegenstandes gebraucht werden zu können, und eben so, wie
stark eine schon angewandte Lauge ist, um etwa noch zu weiteren Zweken zu dienen.
Ich will daher für diese beiden Fälle angeben, wie man dabei den Gasometer
gebrauchen kann:
1) Pruͤfungsart bei einer
liquiden Chlorverbindung.
Wenn eine in Wasser aufgelöste Chlorverbindung, wie z.B. flüssiger Chlorkalk in
der tubulirten Flasche des Gasometers (Fig. 5
B.) mit aufgelöstem, also gleichfalls flüssigem
phosphorsaurem Ammoniak zusammen käme, so würde die Zersezung des Ammoniaks
durch das Chlor so schnell vor sich gehen, daß dabei während des nach offenen
Zustandes der Flasche leicht von dem entwikelten Stikgas verloren gehen kann. Um
daher einen solchen Verlust zu vermeiden, muß das phosphorsaure Ammoniak in fester Gestalt als grobes Pulver auf die
flüssige Chlorverbindung der Flasche geschüttet und diese hierauf schnell
geschlossen werden. Bei 1 Kubikz. eines auch starken in Wasser aufgelösten
Chlorkalks (30 Gr. bei etwa 20 Proc. Chlorgehalts) sind 10 Gr. von
phosphorsaurem Ammoniak mehr als hinreichend, da eine solche Auflösung 6 Gr.
Chlor enthält und 6 Gr. Chlor 9 Gr. phosphorsaures Ammoniak fordern. Gesezt also
z.B., man habe in die Prüfungsflasche 4 Kubikz. Chlorkalkwasser gebracht, 40 Gr.
von dem pulverisirten SalzeZur sichern und schnellen Einbringung kann, man das Salz in Filtrirpapier
einpaken. eingeschüttet und nach gehöriger Erwärmung und darauf geschehener
Abkühlung bei 12–15° R. 6,4 Kubikz. Stikgas erhalten, so
enthielten die 4 Kubikz. Flüssigkeit 6,4/0,4 Gr. Chlor. Nun gehen beinahe 26
rhein. Kubikz. auf einen würtembergischen Schoppen und 104 Kubikz. auf ein Maaß,
man kann daher aus jenem gefundenen Verhältniß von 4 Gr. Chlor in 1 Kubikz.
Chlorwasser leicht finden, wie viel Loth oder Pfund Chlor in einer großen Masse von
gegebenem Chlorkalkwasser vorhanden seyn muß. Weiß man, wie viel Chlorkalk zu
einem andern Chlorkalkwasser gebraucht worden ist, und wie viel Chlor der hiezu
gebrauchte Chlorkalk enthielt, so läßt sich die Stärke (der Chlorgehalt) beider
Chlorkalkwasser mit einander vergleichen.
2) Pruͤfungsart von
Pottasche.
Nach Berand
Nach Berz. enthalten 100 Gr. dieses Salzes
31,82 Gr. Kohlensäure. enthalten 100 Gr. des halbkohlensauren Kali's (reiner Pottasche) 29,79
Gr. Kohlensäure = 55,2 rhein. Kubikz.; aus 10 Gr. dieses Salzes entwikelt sich
daher bei Einwirkung einer stärkeren Säure 5,5 Kubikz. Kohlensäure, die zur
Verhütung ihrer Einsaugung eine gesättigte Auflösung von Bittersalz fordert.
a) Ist nun die Pottasche
(rein oder unrein) in fester Gestalt zu prüfen, so
bringt man eine Mischung von 4 Vol. Wasser mit 1 Vol. concentrirter Salzsäure
zusammen und gießt davon 1 rhn. Kubikzoll in die Entwiklungsflasche des
Gasometers (was hinreicht, um damit aus mehr als 100 Gr. reiner PottascheDenn 100 Gr. reine Pottasche fordern nur 58 Gr. concentr. Salzsäure, und
1/5 jener Mischung enthält 80 Gr. concentr. Salzsäure; man kann demnach
in dieselbe Salzsäure wenigstens 100 Gr. Pottasche nach einander
werfen. alle Kohlensäure auszutreiben); dann wirft man 10 Gr. oder mehr von der
zu prüfenden Pottasche, in etwas Filtrirpapier eingepakt, in die saure
Flüssigkeit, schließt sogleich die Flasche, erwärmt diese, und sieht, wenn keine
Gasblasen mehr erscheinen, nach eingetretener Abkühlung auf die Grade des
Gasometers. Haben z.B. 10 Gr. eines solchen Salzes 4 Kubikz. kohlensaures Gas
entwikelt, so enthielt es nach der Proportion: 5,5 Kubikz. Kohlensäure: 10 Gr.
reine Pottasche = 4 Kubikzoll Gas : X = 7,25 Gr.
reine Pottasche, und das Uebrige bestand aus andern Salzen.
b) Ist aber die Pottasche
in Wasser aufgelöst und in diesem Zustand zu prüfen,
so muß zur Austreibung ihrer Kohlensäure eine feste
Säure gewonnen werben, damit jene sich nicht zu schnell entwikele und
etwas von ihr verloren gehe. Zu diesem Zwek läßt sich Weinsteinsäure, Kleesäure,
Boraxsäure etc. anwenden. Um nun bei 100 Gr. von reiner Pottasche alle
Kohlensäure auszutreiben, braucht man von der Weinsteinsäure 141 Gr., von der
Kleesäure 250 Gr., von der Boraxsäure 130 Gr., u.s.f., und 1 rhein. Kubikz.
einer gesättigten Auflösung von einer durch Wiederkrystallisiren gereinigter
(nicht chemisch reiner) Pottasche enthält bei einem Gewicht von 333,3 Gr. von
dieser PottascheDa eine solche gereinigte Pottasche nicht lauter chemisch reine Pottasche
ist, so enthält ein Kubikzoll von jener noch weniger als 83,3 Gr. reine
Pottasche. 83,3 Gr., so daß ein rhein. Kubikzoll dieser Flüssigkeit gegen 100 Gr.
Weinsteinsäure fordern würde. Da aber eine unreine Pottasche-Auflösung
bei gleichem spec. Gewicht, das bei jener 1,153 ist, 1/3 – 1/2 reine
Pottasche enthalten mag, so kann man nach Eingießung von 1 rhein. Kubikz. unreiner Pottaschenlösung in die Entwiklungsflasche,
wenn sie gesättigt ist, mit 40 bis 50 Gr. Weinsteinsäure ausreichen, nach
Eingießung von 1/2 Kubikz. aber und Verdünnung mit 1/2 Kubikz. Wasser, mit
20–25 Gr., die man in Filtrirpapier gepakt, hineinwirft; ja, in vielen
Fällen genügen schon 10–15 Gr., um 1/2 Kubikz. einer solchen Auflösung zu
zersezen. Zur Versicherung jedoch, daß alles zersezt sey, ist es übrigens gut,
nach geschehener Beobachtung der Grade an dem Meßcylinder die restirende
Flüssigkeit zu untersuchen, ob sie Lakmuspapier noch bläut oder röthet, da in
jenem Fall eine größere Menge von Säure zu derselben Menge von
Pottascheflüssigkeit eingetragen werden müßte. Wenn aber bei solchem Papier
Röthung eingetreten ist, so ist Wiederholung des Versuchs mit mehr
Weinsteinsäure überflüssig und man hat, um aus den beobachteten Kubikzollen von
Kohlensäure die Gewichtsmenge von reiner Pottasche in der geprüften
Pottaschelösung zu berechnen, nur die obige Proportion: (siehe a.) 5,5 Kubikz. verhalten sich zu 10 Gr. reiner
Pottasche, wie die beobachtete Kohlensäuremenge zu der gesuchten reinen
Pottasche in der unreinen, anzuwenden.
Erklaͤrung der
Apparate.
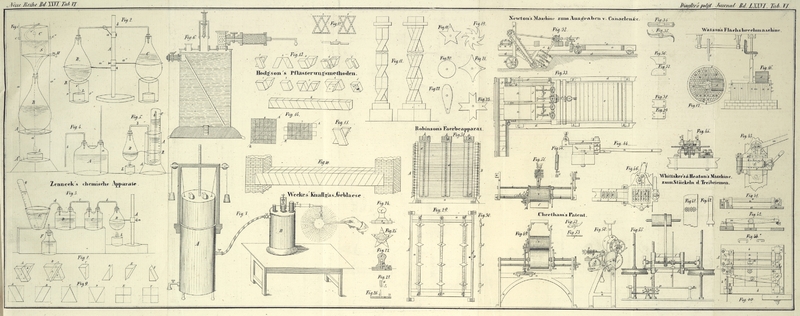
Fig. 1. Einfaches Digerir- (oder auch Koch-) Gestell mit seinem Kuͤhltrichter.
A Sturzscheibe, als Boden für die Phiole B, angelöthet an die
a, a', a'' drei Drahtstangen, an welche unten
gleichfalls angelöthet ist ein
A' Sturzboden für die Lampe L.
B Phiole oder Glaskolben, der auf einem eisernen Reif
b ruht, oder auch in einem Kreisausschnitt von A' sizen kann.
C Blechtrichter, in welchem ein zinnernes Schlangenrohr
zur Abkühlung der Dämpfe eingelöthet ist. Er läuft in den drei Stangen vermittelst
seiner drei Oehrchen c, c' und c''.
Bei Erhizung des Alkohols, der Lauge etc. mit dem Flachs in B fallen die Dämpfe vom Schlangenrohr S des
mit kaltem Wasser gefüllten Trichters wieder zurük und man hat nur jenes von Zeit zu
Zeit (durch einen Heber, oder einen Hahn H) abzulassen,
und es mit kaltem zu ersezen.
Fig. 2. Abwechselnder Digerir- (oder Koch-) Apparat ohne Kühltrichter.
A Retortengestell mit seinen
a, a', a'' drei durch Schrauben (oder durchbohrte Korke)
beweglichen Stangen.
B, C Glaskolben, die durch ein doppeltwinkliches
Glasrohr b mit einander luftdicht in Verbindung stehen,
so daß die heißen Dämpfe des einen Kolbens in den anderen übergehen.
R Ein Metallring mit seinen Füßen r, r' und r'' , als Stellvertreter der Ringe
und Stangen eines Retortengestells. (In Ermanglung des leztern wird das Glasrohr an
irgend eine Stange festgebunden.) Sobald die meisten Dämpfe vom Kolben B z.B. in den Kolben C
übergegangen sind, wird die Lampe L von B hinweg unter C
gestellt.
Fig. 3. Apparat zur Untersuchung der Chlorwirkungen auf
Farbstoffe.
A Träger mit seiner Stange, Ring und Schraube a.
B Glaskolben, der Salzsäure mit Braunstein enthält,
durch b verbunden mit
C tubulirte Flasche, die den zu entfärbenden Körper
enthält, durch c verbunden mit
D tubulirte Flasche mit Ammoniakwasser, so daß das
überschüssige Chlor hier zersezt wird und statt seiner Stikstoff nebst dem Gas, das
etwa in C aus dem Farbstoff entsteht, übergeht durch d in die
E Schüssel, wo es aufgenommen wird von einem
G graduirten Glascylinder, der mit dem Salzwasser der
Schüssel gefüllt ist.
F Einfache Flasche mit Kalkmilch, die man an die Stelle
von D und E sezen kann, wenn
man bloß Chlor nach C auf eine Art leiten will, bei
welcher das überschüssige Gas absorbirt wird.
Das Salzwasser der Schüssel E und des Cylinders G ist am besten Bittersalzlösung; um nun zu finden, ob
der Cylinder G einen Kohlenwasserstoff erhalten hat, so
wird er mit einer Glasscheibe bedekt umgekehrt und im Augenblik des Wegschiebens von
dieser eine brennende Kerze in ihr eingetaucht. Sollte in C Kohlensäure entstanden seyn, so zeigt sie sich theils im Ammoniak von
D (durch Aufbrausen mit einer Säure), theils in G (durch Absorption beim Einbringen von Aezkali unter
der Sperrflüssigkeit).
Fig. 4. Einrichtung zur Untersuchung der Wirkung von bloßem mit der
Atmosphäre in Verbindung stehendem Wasser auf einen Bleichgegenstand.
A Tubulirte Flasche, durch welche einerseits eine
Glasröhre a bis gegen ihren Boden hin luftdicht geht und
von der andrerseits eine
gekrümmte Glasröhre b entweder in eine Schüssel (Fig. 3
E) unter einen Cylinder G,
oder in einen Gasometer (Fig. 5) läuft.
Entstehen bei der gleichzeitigen Einwirkung des Wassers und der Atmosphäre (durch die
Röhre a) Gase, so gehen sie entweder für sich in den
Gasrecipienten über, oder sie lassen sich aus dem Wasser durch Erwärmung von A oder durch Salzsäure, die durch die Röhre a eingegossen wird, austreiben und alsdann (wie bei dem
Apparat von Fig.
3) untersuchen.
Fig. 5. Gasometer zu Chlorkalk- und zu
Pottascheprüfungen.
A Glascylinder mit Fuß zur Aufnahme des
C Meßcylinders, in welchen die von dem
B Glaskolben luftdicht ausgehende Glasröhre b bis nach Oben übergeht,
R Ring von Eisenblech, der den Glaskolben hält. An der
Stelle des lezten einfachen Kolbens dient als bequemer ein tubulirter Kolben mit
oder Hahn, ähnlich den Flaschen von Fig. 3
C u. D, jedoch muß er wegen
der Erhizung durch die Lampe L unten kugelförmig
seyn.
Der Gebrauch dieses Gasometers sowohl zu Chlorkalk- als zu Pottascheprüfungen
ist ausführlich beschrieben in Buchner's Repert. (alte Folge) XLV. H. 2.
Tafeln