| Titel: | Ueber Alkalimetrie und Chlorometrie; von Dr. Ure. |
| Fundstelle: | Band 96, Jahrgang 1845, Nr. X., S. 32 |
| Download: | XML |
X.
Ueber Alkalimetrie und Chlorometrie; von Dr.
Ure.
Aus dem Supplement to Dr.Ure's Dictionary of arts, manufactures
and mines, London 1844 p. 279.
Mit Abbildungen auf Tab.
I.
Ure, über Alkalimetrie und Chlorometrie.
I. Alkalimetrie.
Der nächste Alkalimeter, wovon nach dem bekannten von Descroizilles eine Beschreibung erschien, war mein eigener. Ich benuzte
als Probeflüssigkeit ebenfalls Schwefelsäure; man kann dieselbe sehr leicht und
genau auf den erforderlichen Grad verdünnen, wenn man ein Glaskügelchen von dem
specifischen Gewicht der Probesäure besizt. Um die Probeflüssigkeit herzustellen,
braucht man dann nur das Kügelchen in destillirtes Wasser zu legen und demselben
etwas verdünnte aber reine Schwefelsäure langsam unter Umrühren so lange zuzusezen,
bis das Kügelchen vom Boden aufsteigt und bei 60° F. (12°,4 R.)
Temperatur in der Mitte der Flüssigkeit schwimmt. Die Genauigkeit dieses Verfahrens
ist so groß, daß durch eine Temperaturzunahme um einen Grad die Kugel schon auf den
Boden sinkt; eine solche Genauigkeit kann kein Aräometer gewähren. Die Proberöhre
ist beiläufig 14 Zoll lang, faßt gewöhnlich 1000 Gran Wasser und wird mittelst
Queksilber in 100 gleiche Raumtheile graduirt. Die Probeflüssigkeit wird mit Lakmus
schwach gefärbt; ihre Farbenveränderung, wenn sie sich dem Sättigungspunkt beim
Zusezen von 100 Gran käuflichen Alkalis nähert, gibt dann einen sicheren Anhalt, um
den Versuch mit Erfolg beendigen zu können. Hundert Maaßtheile dieser
Probeflüssigkeit neutralisiren genau 100 Gran wasserfreies Aeznatron (Natriumoxyd)
und folglich sehr nahe 150 Kali. Man kann sich auch eine Kugel für solche
Probeflüssigkeiten herrichten, wovon 1000 Granmaaße 100 Kali neutralisiren, folglich 66 2/3 Natron.
Für genaue Proben muß man das käufliche Alkali vorher von Schwefelverbindungen und
schwefligsauren Salzen befreien, nämlich durch Glühen in Berührung mit chlorsaurem
Kali, wie es Gay-Lussac längst empfohlen hat.
Mein Säuremesser beruht auf demselben Princip; man
bereitet sich mittelst eines Glaskügelchens reines flüssiges Aezammoniak von einer
solchen Stärke, daß 1000 Granmaaße desselben ein bestimmtes Gewicht einer Säure,
z.B. 40 Gran wasserfreie Schwefelsäure neutralisiren. Der Gehalt einer Flüssigkeit
an freier Säure läßt sich mit der durch Lakmus schwach gefärbten
Aezammoniak-Flüssigkeit sehr genau (bis auf den fünfzigsten Theil eines
Grans) in Zeit von fünf Minuten bestimmen. Um meine alkalimetrische Methode den
französischen Gewichten und Maaßen anzupassen, welche jezt auch von den deutschen
Chemikern allgemein angewandt werden, braucht man nur 100 Decigramme anstatt 100
Gran zu nehmen und beim Graduiren etc. eben so zu verfahren.
Wenn das rohe Alkali unterschwefligsaures Salz enthält, sollte man es nicht mit
chlorsaurem Kali calciniren, weil ein Atom unterschweflige Säure dadurch in zwei
Atome Schwefelsäure umgeändert wird, welche also zweimal so viel Alkali sättigen,
als vorher mit der unterschwefligen Säure verbunden war. In solchen Fällen ist es
vorzuziehen, die alkalische Auflösung mit ein wenig neutralem chromsauren Kali zu
versezen, wodurch schwefelsaures Chromoxyd, Wasser und Schwefel entstehen, drei
Körper, welche der Genauigkeit der alkalimetrischen Probe keinen Eintrag thun.
In den Annals of Philosophy Oktoberheft 1817 beschrieb
ich einen Apparat zum Analysiren kohlensaurer Alkalien und Erden; er diente um ihren
Gehalt an Basis aus dem Volum der Kohlensäure zu bestimmen, welche sie beim Auflösen
in Säure entbinden. Ich analysirte damit kohlensaures Ammoniak, Kali und Natron,
Kreide, Dolomit etc. Die Angaben dieses Meßapparats sind so genau, daß man mit Hülfe
der bekannten Regel, die Verhältnisse zweier Metalle aus dem specifischen Gewicht
einer Legirung zu berechnen, auch die Verhältnisse der Basen in einem Gemenge zweier
kohlensaurer Salze aus dem Volum des entwikelten Gases ableiten kann. Dieser kleine
Apparat bestand aus einer gebogenen Glasröhre, welche an einem Ende offen war und am
andern Ende in eine eiförmige Kugel von zwei bis drei Zoll Durchmesser ausging; beim
Gebrauch desselben waren beiläufig fünf Pfund Queksilber erforderlich.
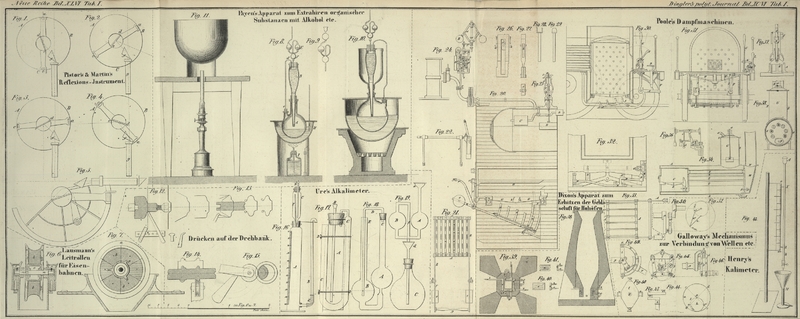
Der gläserne in Fig.
16 abgebildete Apparat ist viel bequemer und eben so genau. A ist ein 14 Zoll langer Cylinder von 2 Zoll Durchmesser. Er faßt in dem
graduirten Theil, welcher oben mit Null beginnt, 10,000 Gran Wasser. Nahe am Boden
ist der Glascylinder zur Seite mit einer Tubulatur versehen, in deren Kork eine
kurze Röhre dichtpassend gestekt wird, welche mit einem Kautschukröhrchen E und durch lezteres mit der senkrechten Röhre B verbunden ist, die an ihrem oberen offenen Ende durch
einen Draht mit Haken gehalten wird. Durch den Kork in der Mündung des Cylinders ist
das in eine Spize auslaufende untere Ende der Flasche C
luftdicht passend gestekt. Die an beiden Enden offene enge Röhre F ist unten in den Schwanz von C gekittet und reicht bis zur Schulter der Flasche hinauf. Der Kork von
C ist durchbohrt und die spize zulaufende Röhre D, welche auch mit dem Sperrhahn geschlossen werden
kann, wird luftdicht durchgestekt.
Dieser Apparat wird folgendermaßen angewandt: man füllt den Cylinder mit Wasser und
bedekt dessen Oberfläche einen halben Zoll hoch mit Oehl; dann stekt man den Schwanz
der Flasche hinein. In die Flasche C bringt man 58,6
Gran kohlensaures Kali oder 45,2 kohlensaures Natron, je nachdem man Potasche oder
Soda zu probiren hat, nebst so viel Wasser, daß das untere Ende von D dadurch ganz bedekt wird, worauf man diese Röhre
einstekt. Eine erkaltete Mischung von beiläufig 40 Theilen concentrirter
Schwefelsäure mit 60 Wasser muß man in einem Fläschchen vorräthig haben Davon nimmt
man in ein Tropfglas 100 Wasser-Granmaaße und saugt dieses Quantum allmählich
in die Röhre D hinauf, worauf man den Sperrhahn
schließt. Wenn man ihn nun langsam öffnet läuft die Säure nach und nach in C aus. Das kohlensaure Gas welches sich jezt entwikelt,
drükt das Wasser in A hinab und bewirk daß es aus der
Röhre B überfließt, welche man in der linken Hand
– ihren Schnabel über einem Schälchen – hält und allmählich auf das
Niveau des fallenden Wassers im Cylinder herabsenkt. Wenn alle Schwefelsäure mit der
rechten Hand eingebracht worden ist, verkorkt man die Oeffnung von D und läßt die Röhre B mit
der linken Hand beständig herab, bis nach beendigtem Aufbrausen das Wasser in A stationär bleibt. Die Zahl auf der hundertgradigen
Scale, der Oberfläche des Oehls gegenüber, bezeichnet nach Abzug von 100
Gran-Maaßen für das Volum der zugesezten Schwefelsäure die Procente reinen
kohlensauren Kalis oder Natrons im untersuchter Muster. Die oben vorgeschriebenen
Gewichte dieser zwei kohlensauren Salze entwikeln, falls dieselben rein sind, durch
die (in schwachen Ueberschuß vorhandene) Schwefelsäure jedes 10,000
Wasser-Granmaaße kohlensaures Gas oder 100 Maaße der Scale auf A. Der Cylinder, welchen ich anwende, enthält beiläufig
12,000 Wasser Granmaaße,
so daß der Boden der hundertgradigen Scala volle zwei Zoll über dem Spiegel der
unteren Tubulatur ist. Diese Capacität und die Graduirung in 120 Theile wird man in
gewissen Fällen, besonders für Analysen von Kali- und
Natron-Bicarbonat,Behufs der größten Genauigkeit kann man bei obigem Versuch heiße Säure
anwenden; man bringt nämlich in eine graduirte Röhre 75 Gran Wasser und
füllt sie dann bis zur Linie 100 hinauf mit concentrirter Schwefelsäure an.
Gießt man diese Mischung nach und nach in die Flasche C (welche im Verhältniß zum Cylinder A
viel zu groß abgebildet ist), so kann man sicher seyn, daß alle Kohlensäure
aus dem Salze ausgetrieben wird und man kann dann die Flasche C abkühlen, indem man sie mit einem in kaltes
Wasser getauchten Leinenlappen umwikelt. bequem finden.
10,000 Wasser-Granmaaße Kohlensäure wiegen bei 60° F. (12°,4 R.)
nur 18,4 Gran und man begreift daher, wie sehr die Scale vergrößert wird, wenn man
bei ihr einen Nonius wie bei den Barometern anwendet. Bei einiger Geschiklichkeit
kann man jedenfalls mittelst dieses Apparats den Gehalt eines kohlensauren Alkalis
leicht bis auf 1/10 Proc. bestimmen.
Beim Probiren von Kreide, Marmor etc. muß man als Normalgewicht derselben 42,1 Gran
nehmen, weil so viel reiner kohlensaurer Kalk beim Auflösen in verdünnter Salzsäure
10,000 Wasser-Granmaaße kohlensaures Gas liefert. Da 100
Wasser-Granmaaße flüssiger Salzsäure von 1,14 spec. Gewicht hinreichen, den
Kalk in dem angegebenen Gewicht Kreide etc. zu übersättigen, so wendet man diese
Quantität an. Der beschriebene Apparat ist bequemer als derjenige, welchen der
scharfsinnige Dr. Mohr in
Coblenz nach ähnlichen Principien construirte.
Probirt man mit diesem Apparat Kali- und Natron-Bicarbonat, so muß man
von ersterem 42 Gran und von lezterem 35 1/2 Gran anwenden; diese Quantitäten
entbinden, wenn die Salze vollkommen rein sind, 10,000 Granmaaße kohlensaures Gas.
Man kann dabei das oben vorgeschriebene Verhältniß von Schwefelsäure anwenden,
obgleich bedeutend weniger davon hinreichend wäre. Die Scalentheile, welche das Gas
in A einnimmt, geben den respectiven Kohlensäuregehalt
der Salze an; ihr Alkaligehalt läßt sich mittelst meines alten Alkalimeters, nämlich
mit gefärbter Probesäure, leicht bestimmen. Da die käuflichen Bicarbonate nicht
immer mit Kohlensäure gesättigt sind, so sollte man sie immer sowohl auf ihren
Säure- als Basisgehalt probiren, wozu auch folgender Apparat anwendbar ist,
womit die Kohlensäure nach dem Gewicht statt nach dem Volum bestimmt wird.
Derselbe ist in Fig. 17 abgebildet und wird in Verbindung mit meinem Alkalimeter gebraucht. A ist das Fläschchen in welches das zu probirende Bicarbonat kommt; B der Trichter, in welchen die Probesäure gegossen wird; C, C ein umgekehrter Heber, mit Stükchen von Chlorcalcium gefüllt, um den Wasserdampf aus dem kohlensauren Gas zu absorbiren.
Der Gewichtsverlust nach der Operation entspricht dem Kohlensäuregehalt; mittelst der alkalimetrischen Röhre kann man den
Gehalt an Basis bestimmen und aus diesen Daten dann das Verhältniß zwischen dem einfach‐ und doppeltkohlensauren Salze leicht
berechnen. So sollten 100 Gran Natron‐Bicarbonat 51¾ Gran Kohlensäure entbinden und 37,6 Maaßtheile der Probesäure sättigen,
welche 37,6 Gran wasserfreiem Aeznatron entsprechen. Enthält dasselbe aber einfach‐kohlensaures Natron, so wird weniger Gas
entwikelt; man wird auch mehr oder weniger Alkali finden, nach dem Grade der Trokenheit des Natronsalzes. Um den Wassergehalt
des Bicarbonats zu bestimmen, glüht man 20 Gran in einer (unten zugeschmolzenen) Glasröhre aus, welche mit dem umgekehrten
Chlorcalcium‐Heber (Fig. 17) verbunden ist; es sollten 10⅓ Gran kohlensaures Gas und 2⅛ Wasser ausgetrieben werden, welche zusammen einen Gewichtsverlust
von 12 11/24 Gran ausmachen, wovon die 2⅛ als Wasser vom Chlorcalcium absorbirt werden. Da aber eine sehr mäßige Hize hinreicht, das zweite
Atom Kohlensäure aus dem Natron‐Bicarbonat auszutreiben, so prüft man es am schnellsten auf die Art, daß man 70¾ Gran davon
über der Weingeistlampe in einem Fläschchen oder einer Retorte erhizt, welche durch eine Röhre luftdicht mit der Mündung des
Cylinders A, Fig. 16, verbunden ist. Wenn das Salz vollkommen rein ist, sollte dieses Quantum ziemlich genau 10,000 Granmaaße Gas ausgeben; erhält
man also z. B. nur 8500 Granmaaße Gas, so enthält das Salz in 100 Theilen 85 Theile Natron‐Bicarbonat. Die krystallinische
Gestalt des Kali‐Bicarbonats ist ein ziemlich genügendes Kennzeichen seiner Güte.
Das kaustische Alkali, welches mit dem kohlensauren vermischt ist, läßt sich durch geschikte Anwendung meines Alkalimeters
schnell und hinreichend genau qantitativ bestimmen; denn bis der kaustische Antheil fast ganz neutralisirt ist, wird wenig
oder kein kohlensaures Gas ausgetrieben. Beginnt endlich das Aufbrausen, so bezeichnen die schon angewandten Maaßtheile von
Probesäure den Procentgehalt an kaustischem Alkali. Das im Zustand von Sulfurid vorhandene Alkali sollte man niemals unberüksichtigt
lassen, weil dasselbe bei vielen technischen Operationen wirksam ist, z. B. bei der Fabrication von gelber Seife, Kronglas,
beim Bleichen von Leinen‐ und Baumwollwaaren etc. Prüft man das Alkali direct mit dem Alkalimeter und zieht von dem gefundenen Gehalt denjenigen ab, welchen man nach
vorläufigem Ausglühen des Alkalis mit chlorsaurem Kali oder Behandlung mit gelbem chromsaurem KaliEnthält das kohlensaure Alkali Sulfurid, schwefligsaures oder unterschwefligsaures Salz, so kann man es mit einem theelöffelvoll
gelbem chromsauren Kali versezen, wodurch schwefelsaures Chromoxyd, Wasser und Schwefel entstehen, welche in dem Apparat zurükbleiben,
ohne auf sein Gewicht zu influenciren. Die Wirkung des neutralen chromsauren Kalis auf das Schwefelkalium wurde von Döpping genau erforscht (Annalen der Chemie und Pharmacie, Mai 1843 S. 172). fand, so ergibt die Differenz das im Zustand von Sulfurid vorhandene Alkali.
Vor einigen Jahren (a few years ago)Es ist wohl kaum zu bezweifeln daß Dr. Ure erst durch die alkalimetrischen Apparate von Fresenius und Will auf die Construction seiner in Fig. 17 und 18 abgebildeten Vorrichtungen geführt wurde.E. D. habe ich den in Fig. 18 abgebildeten Apparat construirt, um kohlensaure Salze dadurch zu analysiren, daß man ihren Gewichtsverlust beim Auflösen
in einer Säure bestimmt. A, B sind zwei gläserne Kugeln, deren jede beiläufig zwei Zoll Durchmesser hat; der untere Hals von A verengt sich beinahe zu einer Haarröhre; die Kugel B steht niedriger und ihre Mittelpunktslinie ist waagrecht mit dem engen Hals von A, A. Die Röhren dieser Kugeln haben beiläufig einen halben Zoll Durchmesser. C wird oben mit einem durchbohrten Kork verschlossen; durch denselben wird eine enge Glasröhre luftdicht gestekt, deren anderer
Schenkel in der Röhre E etwas unter die Mittelpunktslinie der Kugel B hinabreicht. Um mit diesem Apparat kohlensaure Salze zu analysiren, füllt man die Kugel etwas über die Hälfte mit Schwefelsäure.
Das Normalgewicht für kohlensaures Natron ist = 24⅛ Gran, für kohlensaures Kali = 31⅓ Gran; das Alkali bringt man dann in
A, nachdem man zuvor ein Glaskügelchen über die untere Oeffnung gelegt hat; der Kork mit seiner engen Röhre wird hierauf dicht
eingepaßt und der Apparat in senkrechter Stellung gewogen, zu welchem Behuf man ihn entweder mit einem Haken am Ende des Waagbalkens
aufhängt oder in einem leichten Gehäuse auf die Waagschale stellt. Nun ergreift man ihn und neigt ihn so, daß ein wenig Säure
aus B nach A hinüber lauft. Es entsteht dadurch ein mehr oder weniger heftiges Aufbrausen; sollte dasselbe zu stark werden, daß man ein
Uebersteigen befürchten müßte, so kann man es durch die geringste Neigung des Apparats sogleich und beliebig mäßigen. Dieß
ist ein großer Vortheil des Apparats, welchen kein anderer theilt, wobei man die Säure übersaugen oder eingießen muß. Das
in A entwikelte Gas ist genöthigt durch die Schwefelsäure in B zu streichen, welche ihm seine Feuchtigkeit entzieht, bevor es in die Luft entweicht. Nachdem man die alkalische Basis übersättigt und den Apparat abgekühlt hat, wiegt man ihn wieder
und der Gewichtsverlust in Granen und Zehnteln derselben
entspricht dem Procentgehalt der Soda oder Potasche. Für die Kreide ist das
Normalgewicht 22 3/4 Gran. Es verdient bemerkt zu werden, daß dieser Apparat einen
einzigen Korkverschluß hat und kein Chlorcalcium erfordert, welches durch sein
Anschwellen die Glasröhren bekanntlich leicht zersprengt.1000 Wasser-Granmaaße Schwefelsäure von 1,032 spec. Gewicht
neutralisiren 32 Gran wasserfreies Natron (Natriumoxyd) und folglich ein
Atom, nach der Wasserstoff-Skale, von jeder anderen Basis, in Granen
gerechnet.
II. Acidimetrie.
Ich habe schon oben bemerkt, daß eine Auflösung von Aezammoniak in Wasser, auf den
Normalgehalt gebracht und schwach mit Lakmus gefärbt, wenn man sie aus einer
graduirten Tropfröhre in die zu probirende Säure fallen läßt, einen sehr genauen und
bequemen Acidimeter liefert. Kali-Bicarbonat, in Wasser aufgelöst, so daß
1000 Granmaaße ein Atom des Salzes, in Granen gerechnet, enthalten, ist ebenfalls
eine gute Probeflüssigkeit zu demselben Zwek; denn wenn man die Maaßtheile der
hundertgradigen Scale, welche davon zur Neutralisation einer Säure verbraucht
wurden, mit dem Atomgewicht dieser Säure multiplicirt, so ist das Product der
vorhandene Säuregehalt in Granen.
Die acidimetrischen Proben lassen sich auch auf die Art sehr genau anstellen, daß man
in dem cylindrischen Gasmesser Fig. 16 das Volum der
Kohlensäure mißt, welche durch ein bestimmtes Gewicht irgend einer Säure aus reinem
Kali- oder Natron-Bicarbonat entwikelt wird, wobei man jedoch die
Vorsicht gebrauchen muß, einen kleinen Ueberschuß des Salzes anzuwenden. So
entwikeln z.B. 16,8 Gran wasserfreier und 20 2/3 concentrirter Schwefelsäure 10,000
Wasser-Granmaaße Gas aus Kali-Bicarbonat; wenn man folglich 20 2/3
Gran von einer gegebenen Schwefelsäure in das Fläschchen des Apparats Fig. 16 auf
beiläufig 50 Gran des gepulverten und mit ein wenig Wasser bedekten Bicarbonats
gießt, so wird sich ein ihrem Säuregehalt proportionales Gasquantum entbinden. Ist
die Säure reines Vitriolöhl, so wird jenes Gewicht von ihr 10,000 Granmaaße Gas
entwikeln; ist sie aber schwächer, um so weniger und die Maaßtheile des Gasvolums
nach der hundertgradigen Scala geben den Gehalt der Säure in Procenten an. Entsteht
die Frage, wie viele Procent wasserfreier Säure eine gegebene Schwefelsäure enthält, so muß man 16,8
Gran von der zu probirenden Säure anwenden; das Volum der entwikelten Kohlensäure,
welches man an der Scale ablieft, bezeichnet ihren Procentgehalt an wasserfreier
Säure.Das Bicarbonat muß frei von einfach-kohlensaurem Salz seyn, wovon man
überzeugt seyn kann, wenn man das Pulver des Bicarbonats mit kaltem Wasser
ausgewaschen und es dann an der Luft getroknet hat.
Von Salpetersäure muß man 22,6 Gran nehmen; von Salzsäure 15,34; von Essigsäure 21,6;
von Citronensäure 24,6; von Weinsteinsäure 28 Gran: in jedem Falle erhält man dann
ein Volum Kohlensäuregas, welches der respectiven Stärke und Reinheit dieser Säuren
proportional ist. Bei diesen Gewichten beziehen sich die Angaben hinsichtlich der
Salpeter-, Salz- und Essigsäure auf den wasserfreien, hinsichtlich der
Weinstein- und Citronensäure aber auf den krystallisirten Zustand. Sind die
lezteren zwei Säuren rein, so wird eine Auflösung von 24,6 Gran Weinsteinsäure oder
von 28 Citronensäure aus 50 Gran Kali-Bicarbonat 10,000 Granmaaße
kohlensaures Gas entbinden.Damit das Gas vollständig ausgetrieben wird, kann man das Fläschchen mit
einem in heißes Wasser getauchten Zeugstreifen umgeben.
Auch kann man die acidimetrischen Proben auf die Art anstellen, daß man das Gewicht des kohlensauren Gases bestimmt, welches aus
Kali- oder Natron-Bicarbonat durch ein gegebenes Gewicht irgend einer
Säure ausgetrieben wird, wozu man den Apparat Fig. 17 oder Fig. 18
benuzt. Hiebei muß man folgende Gewichte nehmen, für
Grane
wasserfreie
Schwefelsaͤure
9,127
–
Salpetersaͤure
12,33
–
Salzsaͤure
8,29
–
Essigsaͤure
11,67
krystallisirte
Weinsteinsaͤure
13,31
–
Citronensaͤure
15,13
Diese Quantitäten der wasserfreien oder krystallisirten Säuren entwikeln aus 25 oder
26 Gran Kali-Bicarbonat 10 Gran kohlensaures Gas; der Gewichtsverlust des
Apparats, in Granen und Zehntheilen eines Grans gerechnet, bezeichnet die
Säure-Procente des probirten Musters, ohne daß man irgend eine arithmetische
Reduction vorzunehmen hat. Wer an das französische Gewicht gewohnt ist, kann hiebei
Decigramme statt der Grane anwenden.
(Der Verfasser theilt nun die alkalimetrischen etc. Methoden von Fresenius und Will mit, welche
diese Chemiker in einem besondern Werke: „Neue Verfahrungsweisen zur Bestimmung
des Werthes der Potasche und Soda, der Säuren und des Braunsteins, Heidelberg
1843“ beschrieben haben, woraus ein Auszug im polytechnischen Journal
Bd. XC S. 126 und 210 enthalten ist.
Nach Ure's Ansicht müßte das ganze Werk der deutschen
Chemiker umgearbeitet werden, um ihren Prüfungsmethoden in England Eingang zu
verschaffen, wo die technischen Chemiker und Apotheker nur mit Grangewichten zu
arbeiten und nach der Wasserstoff-Scale der Atomgewichte zu rechnen gewohnt
sind.)
III. Chlorometrie.
Man kann den Werth des Braunsteins sehr genau dadurch bestimmen, daß man das Chlor
ermittelt, welches ein bestimmtes Gewicht davon mit Salzsäure liefert; das Chlor
selbst bestimmt man durch die Menge Eisenvitriol-Auflösung, welche es in
Oxydsalz verwandelt. Dieses Verfahren, welches schon Dalton zum Probiren des Chlorkalks anwandte, wurde seitdem von Walter Crum verbessert. Da zwei Atome grünes schwefelsaures
Eisen, um sich in rothes Salz zu verwandeln, nur ein Atom Sauerstoff erfordern, so
muß dieß auch durch ein Atom Chlor bewirkt werden, welches bei seiner Zersezung des
Wassers ein Atom Sauerstoff an den Eisenvitriol abgibt, während es sich ein Atom
Wasserstoff aneignet und damit Chlorwasserstoffsäure bildet.
Das Gewicht von 2 Atomen grünem Eisenvitriol ist 278 = (139 × 2), denn er
besteht aus 2 Atomen Eisenoxydul = 72, + 2 Schwefelsäure = 80, + 14 Wasser = 126; im
Ganzen = 278; dieses Gewicht ist äquivalent 36 Chlor, 8 Sauerstoff und 44
Mangansuperoxyd.Berzelius nimmt in der vierten Ausgabe seines Lehrbuchs das Atom des grünen Eisenvitriols zu
129,43 (Wasserstoff = 1) an, weil er nach Mitscherlich nur 6 Atome Wasser enthält. Ich habe mich durch die
sorgfältigsten Versuche überzeugt, daß er 7 Atome Wasser enthält und daß 139
Gran davon (oder 138,44 nach Berzelius) 1 Atom
Chlorbaryum und sehr nahe 40 Gran Eisenoxyd äquivalent sind.Dieser merkwürdige Irrthum entstand wahrscheinlich dadurch, daß der
Wassergehalt des Salzes durch feinen Gewichtsverlust beim Entwässern
bestimmt wurde. Ich habe mich jedoch überzeugt, daß es auf diese Weise nicht
möglich ist, mehr als 6 Atome Wasser auszutreiben, ohne daß eine theilweise
Zersezung des Salzes eintritt und Schwefelsäure frei wird. Der so
entwässerte Eisenvitriol hat eine solche Verwandtschaft zum Wasser, daß er
im Verlauf einer Stunde nicht weniger als den zehnten Theil seines Gewichts
Feuchtigkeit absorbirt. (Nach Mitscherlich,
dessen Abhandlung Ure nicht zu kennen scheint,
bleibt Eisenvitriol mit 1 Atom Wasser beim Erhizen des Salzes mit 7 Atomen
Wasser bis zu 140° C. im Vacuum zurük; das lezte Atom Wasser verliert
das Salz erst über 280° C. E. D.) Nehmen wir also eine Auflösung von Eisenvitriol, welche 278 Gran in 1000
Wasser-Granmaaßen enthält, so wird dieses Volum Flüssigkeit durch die Verwandlung
ihres Oxyduls in Oxyd, genau 1 Atom Mangansuperoxyd = 44 Gran oder 1 Atom Chlor = 36
repräsentiren. Man stellt daher die Probe folgendermaßen an:
In das Kölbchen C meines chlorometrischen Apparats Fig. 19 bringt
man 100 Gran von dem zu probirenden Braunstein und in die Kugeln A, B gießt man aus einer Alkalimeterröhre, welche mit
1000 Granmaaßen der erwähnten Eisenvitriol-Auflösung gefüllt ist, 200 bis 500
Granmaaße aus, je nach der wahrscheinlichen Güte des Braunsteins; dann bringt man
durch den Trichter d etwas Salzsäure von bekanntem
specifischen Gewicht (etwa 1, 1), welche nahe 20 Procent Chlor enthält, ebenfalls
aus einer Alkalimeterröhre hinein und erwärmt den Boden des Kölbchens gelinde, indem
man es in eine Schale mit Wasser stellt, welche über einer Weingeistlampe steht. Das
entwikelte Chlor entweicht durch die Röhre f (welche in
C bloß über den Kork hineinreicht) und tritt in die
Auflösung in B und A, welche
sie in rothes schwefelsaures Eisen verwandelt. Man muß nun Papier vorräthig haben,
welches mit einer Auflösung von rothem eisenblausaurem
Kali getränkt und dann getroknet worden ist. Man taucht ein dünnes Stäbchen von
Fischbein in die Flüssigkeit in der Kugel A durch den
Trichter e (welcher in der Figur etwas zu hoch über der
Kugel abgebildet ist) und berührt dann das Papier mit der Spize des Stäbchens. So
lange es einen blauen Flek erzeugt, ist noch immer etwas Eisen als schwarzes Oxyd
vorhanden und man muß dem Braunstein von Zeit zu Zeit noch etwas Salzsäure zusezen,
so lange sich noch Chlorgas entwikelt und das Niveau der Flüssigkeit in A über jenem in B erhält.
Sobald die Flüssigkeit durch die Einwirkung des Chlors aufhört das Reagenspapier
blau zu färben, muß man ihr Eisenvitriol-Auflösung aus der graduirten Röhre
zusezen, bis sie anfängt es wieder blau zu färben. Durch vorsichtiges Zusezen von
Salzsäure einerseits und von Eisenvitriol-Auflösung andererseits, kann man
den Sättigungspunkt in wenigen Minuten erreichen. Der Braunstein hat dann alles
Chlor erzeugt, welches er liefern kann. Wenn man die Anzahl Wasser-Granmaaße
der Probe-Flüssigkeit oder die Grade ihrer Alkalimeter-Scale mit 44
multiplicirt, bezeichnet das Product die Procente reinen Braunsteins in dem
angewandten Muster; multiplicirt man sie mit 36, so bezeichnet das Product das
Gewicht Chlor, welches 100 Gran des Braunsteins liefern können.
Da 1 Atom reiner Braunstein (44 Gran), um 36 Gran Chlor zu erzeugen, 2 Atome = 74
Gran Salzsäure verzehrt, so ergibt das Quantum Säure, welches aus den graduirten
Röhren mehr verbraucht
wurde, als dem erhaltenen Chlor entspricht, wie viel Säure durch fremdartige
Bestandtheile des Braunsteins unnüz verzehrt wird. Jeder Gran Chlor sollte, mit
Pyrolusit, durch einen Aufwand von wenig mehr als 2 Gran wasserfreier Salzsäure
erzeugt werden. Die flüssige Salzsäure von 1,093 spec. Gewicht enthält in 1000
Granmaaßen genau 200 Gran wasserfreie Säure; daher sollten 100 Gran reiner Pyrolusit
beiläufig 82 Gran Chlor liefern und beiläufig 169 wasserfreie Salzsäure = 845
Granmaaße flüssiger Säure von 1,093 spec. Gewicht verzehren. Anstatt 100 Gran
Braunstein kann man für die Probe je nach den Dimensionen des Apparats auch nur 20
oder 30 Gran anwenden.
Wünscht man aber direct Braunstein-Procente
mittelst der graduirten Röhren zu erfahren und der Berechnung überhoben zu seyn, so
nimmt man auf 10 Gran des Musters eine Auflösung von frischem grünem Eisenvitriol
(frei von anhängender Feuchtigkeit), welche 632 Gran in 10,000 Granmaaßen enthält
und verfährt nach obiger Vorschrift. Ist der Braunstein reines Superoxyd, so werden
10 Gran desselben so viel Chlor erzeugen, als genau hinreicht um 1000 Granmaaße
dieser Eisenvitriol-Auflösung oder 100 Grade nach der Probirröhre zu
oxydiren. Enthält aber der Braunstein nur 40 oder 50 Procent Superoxyd, so sind 40
oder 50 hundertgradige Maaße der Probeflüssigkeit dem entbundenen Chlor
äquivalent.
Wünscht man hingegen directe Angaben in Bezug auf das Chlor zu erhalten, so benuzt man eine Auflösung von 772 Gran Eisenvitriol
in 10,000 Granmaaßen Wasser; je zehn Granmaaße dieser Flüssigkeit oder ein Grad der
Centesimal-Scale der Probirröhre, welche oxydirt werden, entsprechen 1 Gran
(nuzbaren) Chlors im Chlorkalk, Chlornatron etc. Die Eisenvitriol-Auflösungen
für solche Proben muß man in gut verkorkten Flaschen aufbewahren, auf anderen Boden
sich ein wenig gepulvertes Schwefeleisen befindet, welches man von Zeit zu Zeit
aufschüttelt, um das Eisen im Zustand von Oxydul zu erhalten.
Den Braunstein sollte man vor dem Probiren immer mit verdünnter Salpetersäure
behandeln; wenn er damit aufbraust, muß man 100 Gran desselben so lange mit der
Säure digeriren, daß sich alle vorhandenen kohlensauren Salze auflösen können, ihn
dann auf ein Filter bringen, auswaschen und troknen, bevor man die Probe vornimmt.
Der Gewichtsverlust, welchen der Braunstein hiebei erleidet, entspricht seinem
Procentgehalt an kohlensauren Salzen.
Das Verfahren den Braunstein mit Kleesäure und Schwefelsäure zu probiren verdankt man
Berthier und Dr. Thomson; es wurde in der lezten Zeit von Fresenius und Will verbessert,
welche neutrales
kleesaures Kali anwenden, womit man genauere Resultate erhält. Ich verfahre hiebei
folgendermaßen: in die Kugel A meines Apparats Fig. 18 bringe
ich 100 Gran von dem zerriebenen Braunstein mit 250 Gran neutralem kleesauren Kali
und etwas Wasser; das Ganze wird auf der Schale einer Waage gewogen; dann bewirke
ich durch sanftes Neigen, daß von der concentrirten Schwefelsäure in B etwas in A hinauf gelangt.
Der aus dem Braunstein frei werdende Sauerstoff wirkt sogleich auf die Kleesäure und
verwandelt sie in kohlensaures Gas, welches durch B
streicht und darin seine Feuchtigkeit absezt, bevor es in die Luft entweicht. Wenn
die Gasentbindung aufhört, nachdem so viel Vitriolöhl in die Kugel A übergegangen ist, daß die Kleesäure vollständig
zersezt werden konnte, zieht man auf einen Augenblik den Kork heraus, um die
Kohlensäure durch Luft zu ersezen, kühlt dann den Apparat ab und wiegt ihn. Der
Gewichtsverlust in Granen entspricht den Procenten reinen Mangansuperoxyds im
untersuchten Braunstein. Ist der Braunstein rein, so darf kein schwarzes Pulver
zurükbleiben.
Durch die Kleesäure-Probe kann man auch erfahren, wie viel Säure verschiedene
Braunsteinsorten bei der Chlorbereitung unnüz verzehren: – 44 Gran reines
Mangansuperoxyd mit 93 Gran neutralem kleesauren Kali und 98 Vitriolöhl entbinden 44
Gran Kohlensäure und liefern eine vollkommen neutrale Auflösung; denn die eine
Hälfte der Schwefelsäure = 49 Gran, bildet 1 Atom schwefelsaures Mangan und die
andere Hälfte derselben 1 Atom schwefelsaures Kali. Was an Kohlensäure weniger
entbunden wird, entspricht fehlendem Mangansuperoxyd; die Menge der freien
Schwefelsäure kann man mittelst einer Normalauflösung von Kali-Bicarbonat
bestimmen und die neutralisirte Quantität, verglichen mit dem erzeugten kohlensauren
Gas, ergibt den Betrag der unnüz verzehrten Säure.
Abänderungen der beschriebenen Apparate. – In Fig. 16 kann
die Röhre D auch eine graduirte seyn, welche die nöthige
Menge Säure für die alkalimetrischen oder acidimetrischen Proben faßt; und wenn sie
sich unten in ein Haarröhrchen endigt, wird von ihrem Inhalt nichts ausfließen, bis
man den Sperrhahn in der oberen Mündung öffnet.
In Fig. 17
kann man mit Vortheil statt des Trichters B eine Röhre
wie D (in Fig. 16) anwenden; und da
diese Röhre D so groß seyn kann, daß sie genug Säure zum
Uebersättigen der kohlensauren salze in dem Fläschchen A
faßt, so ist kein besonderes Gefäß mehr erforderlich, welches die zersezende Säure
enthält. Dadurch wird der Apparat sehr leicht und kann folglich in die kleine Schale
einer feinen Waage gestellt werden, während die beiden Kölbchen von
Fresenius und Will eine sehr
breite Waagschale erfordern. Ich schmeichle mir, daß der so abgeänderte Apparat Fig. 17 den
praktischen Chemikern sehr willkommen seyn wird, weil sie damit im Stande sind nicht
nur kohlensaure Salze, sondern auch Braunstein und Bleichsalze schnell und genau zu
probiren, deren Werth sie durch das Gewicht des entwikelten kohlensauren Gases nach
den oben erklärten Principien bestimmen.
Bei dem Apparat Fig.
18 muß man, nachdem die Schwefelsäure in die Kugel B gegossen ist, ein wenig Wasser in C gießen,
ehe man das kohlensaure Salz hineinbringt. Dadurch verhindert man, daß in das
Haarröhrchen unter der Kugel A festes Salz gelangen
kann.
Crum's neue Methode schwache Lösungen von Chlorkalk zum
Bleichen der Waaren zu prüfen.
Der Bleicher sollte die Auflösungen von Chlorkalk worin Waaren gebleicht worden sind,
stets untersuchen, um sie durch Zusaz von frischem Chlorkalk wieder genau auf die
erforderliche Stärke bringen zu können. Zu diesem Zwek hat Walter Crum vor einigen Jahren ein sehr einfaches Verfahren in
seiner Fabrik eingeführt, welches augenbliklich das Resultat angibt. Es beruht auf
der Tiefe der Farbe einer Lösung von essigsaurem Eisenoxyd und wurde von Prof. Dr. Schubarth aus den Proceedings of the Glasgow philosophical Society 1842 No.
2 in den Verhandlungen des Vereins zur Beförderung
des Gewerbfleißes in Preußen, 6te Lief. 1844 mitgetheilt:
„Man löst Eisenfeilig in Salzsäure auf, welche nur halb so stark ist als
gewöhnlich, und dampft die Lösung in Berührung mit Eisenspänen ab. Ein Maaß
dieser Lösung von 40° Twaddell (1,200) mischt man mit einem Maaß
Essigsäure, wie solche für 8 Shilling der Gallon (nahe 4 Quart) von Turnbull u. Comp. in Glasgow verkauft wird. Dieß gibt
die Probeflüssigkeit. Mischt man sie mit 6 oder 8 Theilen Wasser, so wird sie
fast farblos; Chlorkalk erzeugt aber damit essigsaures Eisenoxyd von einer
eigenthümlichen dunkelrothen Farbe.
Man nimmt 12 gleich große Glasstaschen, gibt in jede, bis zu 1/9 des Inhalts
derselben, von der Probeflüssigkeit, und füllt sie dann mit Bleichflüssigkeit
von verschiedener Stärke voll. In die erste Flasche Flüssigkeit von 1/12°
nach Twaddell, in die zweite von 2/12°, in die dritte von 3/12°, bis
zulezt von 12/12° oder einem vollen Grad. Man verpfropft die Flaschen und
stellt je 2 und 2 neben einander in ein Stük Pfosten, in welches runde Löcher
eingebohrt sind, welche den Flaschen einen sichern Stand gewähren.
Um nun die Stärke einer unbekannten und theilweise erschöpften Lösung kennen zu
lernen, gießt man die Probelösung von Eisen in eine ähnliche Flasche, als
diejenigen sind, die zum Instrument gehören, und füllt dieselbe damit zu 1/9,
sezt dann die zu untersuchende Bleichflüssigkeit hinzu, schüttelt um und stellt
die Flasche neben diejenige des Instruments, welche mit dem Inhalt die größte
Aehnlichkeit hat. Die Nummer dieser Flasche ist ihre Stärke in Zwölftheilen
eines Grades am Twaddell'schen Hydrometer. Blikt man nun in die unten angefügte
Tabelle, so kann man finden, wie viel von einer Chlorkalklösung, welche 6 Grad
zeigt, und eben vorräthig gemacht worden, zu nehmen ist, um die ganze
Flüssigkeit in der Bleichbütte auf eine gewünschte Stärke zu bringen.
Die Flaschen, welche zu dieser Vorrichtung gehören, fassen zwei Unzen, und sind,
damit sie gleiches Volum fassen, in Formen geblasen, absichtlich lang gefertigt
und geschliffen. Sie werden zwei und zwei neben einander gestellt, aber so, daß
zwischen je zwei ein Raum für eine Flasche leer bleibt. Man kann nun bequem das
Glas mit der zu untersuchenden Flüssigkeit dazwischen stellen, und sie mit dem
Inhalte der links oder rechts daneben stehenden vergleichen. Zu dem Ende ist
hinter den Flaschen ein Brett angebracht, mit weißem Papier überzogen.
Um den Gebrauch der Tabelle zu erklären, ist es nöthig anzuführen, daß die in
Gebrauch stehenden Bleichbütten 1440 Gallons bis zu der bestimmten Höhe gefüllt,
zu welcher sie behufs des Bleichprocesses gefüllt werden, enthalten, oder 288
Maaß jedes zu 5 Gallons. In der Tabelle ist Wasser mit 0 bezeichnet, die Zahlen
1, 2, 3 u.s.w. bezeichnen die Stärke der Flüssigkeit, welche sich in dem Gefäß
so eben befindet, nach Zwölftheilen eines Grades der Twaddellschen Scala, durch
das Chlorometer ermittelt.
Soll nun der Bottig von Neuem gefüllt werden, so finden wir in der ersten
Tabelle, daß 32 Maaß der Flüssigkeit von 6° zugesezt werden müssen zu
(256 Maaß) Wasser, um 288 Maaß einer Bleichflüssigkeit von 8/12 eines Grades zu
erhalten. Wenn aber die Flüssigkeit, welche sich in dem Bottig befindet, nach
der chlorometrischen Prüfung eine Farbe gezeigt hat, gleich der der zweiten
Flasche, dann sind bloß 24 Maaß nöthig u.s.w.
Bei
8/12°
Bei
6/12°
Bei 4/12°
Bei
3/12°
0 erfordert
32 Maaß
0 erfordert
24 Maaß
0 erfordert
16 Maaß
0 erfordert
12 Maaß
1
–
28 –
1 –
20 –
1 –
12 –
1 –
8 –
2
–
24 –
2 –
16 –
2 –
8 –
2 –
4 –
3
–
20 –
3 –
12 –
3 –
4 –
4
–
16 –
4 –
8 –
5
–
12 –
5 –
4 –
6
–
8 –
7
–
4 –
Der Hergang bei diesem Zersezungsprozeß ist folgender: ein Drittheil des Eisens
bildet ein dunkelroth gefärbtes essigsaures Eisenoxyd, wenn man essigsaures
Eisenoxydul statt Eisenchlorür anwendet. Das leztere ist aber vorzuziehen, weil
das essigsaure Eisen eine größere Anziehung gegen den Sauerstoff der Luft
äußert, und daher leichter während des Aufbewahrens verdirbt. Auch hinsichtlich
der Eisenchlorürlösung (bei Dalton's Chlorkalkprobe)
ist es anzurathen, nur kleine Quantitäten auf einmal zu fertigen und in kleinen
wohl verschließbaren Flaschen aufzubewahren, damit die Luft nicht hinzutreten
kann.“
Tafeln