| Titel: | Ueber Bleizuckerfabrication; von Prof. W. Stein. |
| Fundstelle: | Band 124, Jahrgang 1852, Nr. XXVIII., S. 122 |
| Download: | XML |
XXVIII.
Ueber Bleizuckerfabrication; von Prof. W. Stein.
Aus dem polytechn. Centralblatt, 1852, 7te
Lieferung.
Mit Abbildungen auf Tab.
II.
Stein, über Bleizuckerfabrication.
Wenn zur Darstellung des Bleizuckers die Bleiglätte in einem Essig gelöst wird,
welcher unter Anwendung von Malzauszug oder zuckerhaltigen Flüssigkeiten bereitet
worden ist, so erhält man Krystalle, welche mehr oder weniger gefärbt sind und oft
mehrmals umkrystallisirt werden müssen, um farblos erhalten zu werden. Die braunen
Mutterlaugen aber lassen sich in der Regel nicht anders verwerthen, als dadurch, daß
man das Bleioxyd durch kohlensaures Natron ausfällt, das entstehende kohlensaure
Bleioxyd zur Wiederauflösung in Essig benutzt, und das gleichzeitig gebildete
essigsaure Natron, durch entsprechende Behandlung gereinigt, zu verkaufen sucht.
Dadurch entstehen für den Fabrikanten Verluste, welche durch Entfärbung der Laugen
mit Kohle nicht beseitigt werden können, weil diese bekanntlich ein basisches
Bleisalz niederschlägt.Beim Wiederauflösen der in erster Krystallisation erhaltenen Krystalle wird
allerdings eine geringe Menge Kohle zugesetzt, welcher man später das
basische Salz durch Essig wieder entzieht. Man wendet aus diesem
Grunde bisweilen destillirten Essig an, allein auch dieses Verfahren ist mit
Verlusten verknüpft, da bekanntlich bei der Destillation des Essigs ein großer Theil
der Essigsäure im Destillationsrückstande bleibt und das Destillat stets schwächer
ist, als der zur Destillation angewendete Essig.
Von einem Fabrikanten aufgefordert, ihm ein zweckmäßiges Verfahren zur Gewinnung des
Bleizuckers anzugeben, habe ich Versuche angestellt, von denen ich das Wesentliche
im Folgenden mittheilen will. Ich habe zuerst durch dieselben gefunden, daß durch Kohle
eine Entfärbung des Essigs selbst nicht immer gelingt, auch aus einer mit gefärbtem
Essig bereiteten Bleizuckerlösung durch Bleiessig der Farbstoff nicht vollständig
niedergeschlagen werden kann. Wohl aber kann man auf drei Wegen dazu gelangen,
mittelst eines aus Weingeist oder weingeistigen Flüssigkeiten gewonnenen Essigs, mit
dem geringsten Verluste, einen vollkommen farblosen Bleizucker darzustellen, nämlich
1) indem man einen von allen färbenden Bestandtheilen freien
Essig erzeugt; 2) indem man gefärbten Essig
destillirt; u. 3) indem man rohen farblosen Essig und
Essigdämpfe gleichzeitig anwendet.
1) Darstellung eines von färbenden Stoffen
freien Essigs.
Ein solcher läßt sich nur nach dem Wagenmann'schen
Verfahren und zwar auf folgende Weise erhalten: Man bedient sich der gewöhnlichen
Essigbildner, laugt aber diese selbst, so wie die Buchenspäne vor dem Einbringen in
dieselben, wiederholt und sorgfältig mit warmem Wasser aus. Das Essiggut aber
bereitet man sich nur aus reinem Essig, Spiritus und Wasser und zwar nimmt man am
besten 1 Theil Spiritus von 50 Proc. Tr., 2 Theile Essig und 6 Theile Wasser. Hat
man dann die Buchenspäne durch mehrmaliges Aufgießen von warmem Essig gehörig
angesäuert, so erhält man aus obiger Mischung einen Essig von 6 bis 6,5 Proc.
Essigsäurehydrat. Wenn man der einmal durch die Essigbildner gegangenen Flüssigkeit
noch einige Procente Spiritus zusetzt, so gelingt es sogar, einen 8procentigen Essig
ohne Mühe zu erhalten. Mit einem solchen Essig läßt sich nicht nur ein vollkommen
farbloser Bleizucker darstellen, es ist sogar möglich, ein blendend weißes
essigsaures Kali damit zu erhalten, was bekanntlich viel schwieriger ist, da dieses
Salz nicht krystallisirt, sondern durch Abdampfen seiner Lösung zur Trockne
ausgeschieden wird.
Bei Benutzung eines solchen Essigs zur Bleizuckerfabrication prüft man ihn mit Hülfe
des Otto'schen Acetimeters auf seinen Gehalt an
Essigsäurehydrat und nimmt auf je l00 Pfd. desselben das doppelte Gewicht des
gefundenen Essigsäuregehalts an Bleiglätte.Essigsäurehydraht = C4
H4
O4 = 78.
Bleioxyd = 111,7; man hat also einen kleinen Ueberschuß an Bleioxyd, welcher
jedoch, da die Bleiglätte nie chemisch rein ist, keinen Nachtheil
bringt. Die Auflösung wird in einem kupfernen Kessel oder einer bleiernen
Pfanne vorgenommen und durch Wärme unterstützt. Dabei findet man, daß die röthliche
Farbe der Bleiglätte schnell verschwindet, dagegen ein weißes Pulver zum Vorschein
kommt, welches der Auflösung lange widersteht. Dieses weiße Pulver besteht aus
kohlensaurem Bleioxyd, welches von einer so schwachen Essigsäure, wie sie nach
Auflösung des Bleioxyds in der Flüssigkeit etwa noch vorhanden seyn könnte, nur
schwierig gelöst wird.Bei Anwendung der angegebenen Verhältnisse von Essigsäure und Bleiglätte wird
in der Regel keine freie Essigsäure mehr in der Flüssigkeit vorhanden
seyn. Die Menge desselben ist verschieden, je nachdem die
Bleiglätte frisch bereitet, oder längere Zeit an der Luft gelegen hat. Dasselbe wird
gesammelt, und, wenn eine hinreichende Menge davon zusammen gekommen ist, für sich
allein in Essig aufgelöst.
Die Bleizuckerlösung, welche man auf die eben angegebene Art erhält, wird bei
Anwendung eines achtprocentigen Essigs in 116 Pfd. nicht mehr als 25 Pfd. Bleizucker
(A P b O, 3 a q)
enthalten können, welche beim Kochen ihr gleiches, bei gewöhnlicher Temperatur
ungefähr ihr anderthalbfaches Gewicht Wasser zur Lösung erfordern. Sie muß deßhalb
bis auf circa 50 Pfd. abgedampft werden und liefert dann ungefähr 13 Pfd. blendend
weißer Krystalle, die man von der im Handel verlangten Größe erhält, indem man große
Mengen von Lauge in hölzernen Bottichen erkalten läßt, bei kleineren Mengen die
Gefäße in einen warmen Raum stellt oder endlich die Lösung überhaupt nicht bis zu
der angeführten Stärke concentrirt, sondern die Abdampfung durch Kochen früher
unterbricht und die Krystallbildung durch freiwillige Verdunstung in einem warmen
Raume erfolgen läßt. Das Trocknen der Krystalle erfolgt auf Horden, im Sommer im
Schatten, im Winter in einem nicht über 10° R. warmen Raume. Die wohl stets
kupferhaltige Mutterlauge kann man so lange der frischen Lösung wieder zusetzen, bis
die aus einer solchen sich absetzenden Krystalle bläulich gefärbt erscheinen.
Alsdann legt man einige Stücke metallisches Blei in dieselbe, um das Kupfer
auszufällen. Daß dieses weiter verwerthet werden kann, wenn seine Menge groß genug
ist, braucht nicht erwähnt zu werden, ebensowenig, daß die vom Kupfer befreite
Flüssigkeit als eine reine Bleizuckerlösung zu betrachten ist. Bekannt ist auch, daß
beim Abdampfen einer Bleizuckerlösung Essigsäure entweicht, dadurch ein basisches
Salz entsteht, welches die Krystallisation des Bleizuckers hindert und deßhalb durch
Zusatz von frischem Essig, der am zweckmäßigsten erst nach beendigter Abdampfung
erfolgt, in neutrales zurückgeführt werden muß.
2) Darstellung eines farblosen Bleizuckers
aus gefärbtem Essig.
Ist der Bleizuckerfabrikant nicht selbst Besitzer einer Essigfabrik, so wird es ihm
schwer fallen, einen von färbenden Stoffen freien Essig zu erhalten, weil für den
gewöhnlichen Handel jeder Essig nicht bloß nicht farblos hergestellt, sondern sogar
absichtlich noch gefärbt wird, um ihm das Ansehen des Weinessigs zu geben. —
Da indessen der mit Bleioxyd gesättigte Essig unter allen Umständen abgedampft
werden muß, um Krystalle von Bleizucker zu liefern, so wird man ohne Verlust auch
aus einem gefärbten Essig farblose Krystalle von Bleizucker erhalten können, wenn
man im Stande ist, durch Destillation nicht nur alle
Essigsäure aus dem rohen Essig zu gewinnen, sondern sogar seinen Säuregehalt dadurch
noch zu concentriren. Bei der gewöhnlichen Destillation des Essigs geht nahezu
⅓ der Essigsäure dadurch verloren, daß sie im Rückstände bleibt. Dieß
beweisen die Bestimmungen der Pharmakopöen über die Stärke des destillirten Essigs,
so wie auch die nachstehend beschriebenen Versuche dafür sprechen:
a) 12 Unzen Essig von 5¾ Proc. Säuregehalt wurden
aus einem Kolben destillirt und 5 Portionen zu je zwei Unzen aufgefangen. Die erste
Portion zeigte einen Säuregehalt von 4 Proc.; die zweite von 4¼ Proc.; die
dritte von 4¼ Proc.; die vierte von 5½ Proc. und die fünfte von 6
Proc. Es waren sonach in den überstillirten 10 Unzen Essig 2 × 4 + 4 ×
4¼ + 2 × 5½ + 2 × 6 = 48 Proc. Essigsäurehydrat gewonnen
worden, während in den angewendeten 12 Unzen Essig 12 × 5¾ = 69 Proc.
enthalten waren. Die im Kolben rückständigen zwei Unzen mußten sonach 21 Proc.
enthalten, was nahezu ⅓ der Gesammtmenge beträgt.
b)12 Unzen Essig von 6¼ Proc. wurden in gleicher
Weise destillirt. Die überdestillirten 10 Unzen wurden gemischt und zeigten
5½ Proc. Säuregehalt, enthielten demnach 10 × 5½ = 55 Proc.,
während der angewendete Essig 12 × 6¼ = 75 Proc. enthielt. Im
Rückstände befanden sich also noch 20 Proc., was durch directe Prüfung bestätigt
wurde, indem der Säuregehalt des Rückstandes nahezu zu 10 Proc. sich ergab. Der
Verlust in diesem Versuche ist etwas geringer als im ersten, und es kann wohl überhaupt angenommen
werden, daß derselbe nicht constant, sondern nach der verschiedenen Stärke des
angewendeten Essigs, vielleicht auch bei verschiedenem Luftdruck, verschieden
ist.
Die Ursache dieses Verlustes liegt darin, daß das Essigsäurehydrat einen höhern
Kochpunkt hat, als das Wasser oder der Essig, daß sonach bei der Destillation des
letztern so lange Dämpfe gebildet werden, welche reicher an Wasser sind als der
Essig selbst, bis endlich das Essigsäurehydrat (oder ein Polyhydrat) als solches,
sich verflüchtigt.
Es muß ausdiesem Grunde aber auch möglich seyn, alle Essigsäure aus dem Essig zu
gewinnen und sogar in dem Destillate zu concentriren, wenn man den Kochpunkt des
Essigs auf irgend eine Weise erhöht. Zu diesem Zwecke stellte ich folgende Versuche
an:
a) In 12 Unzen Essig von 6¼ Proc. wurden 4 Unzen
Bleizucker gelöst, wobei sich jedoch ergab, daß der Kochpunkt nicht verändert wurde
und das erste Destillat von 2 Unzen nur 3½ Proc. Säuregehalt hatte.
b) 6 Unzen desselben Essigs wurden nun mit 2 Unzen
Kochsalz zum Kochen gebracht. Der Kochpunkt stieg auf 84° R. Die ersten zwei
Unzen Destillat zeigten einen Gehalt von 9½ Proc.; die zweiten von 6 Proc. Es
waren sonach gewonnen 2 × 9½ + 2 × 6 = 31 Proc., und der
Verlust betrug demnach nur 6½, oder 1/6 der Gesammtmenge.
c) 6 Unzen desselben Essigs, auf gleiche Weise mit
Kochsalz vermischt und destillirt, gaben ein noch günstigeres Resultat, indem die
ersten zwei Unzen 11 Proc., die zweiten 7 Proc. zeigten, somit 36 Proc. gewonnen und
nur 1½ Proc. im Rückstände geblieben waren.
In den beiden Versuchen b und c zeigte salpetersaures Silberoxyd in dem Destillat nur eine Spur von
Salzsäure an.
In der Voraussetzung, durch Anwendung von Chlorcalcium anstatt des Kochsalzes ein
noch günstigeres Resultat zu erhalten, stellte ich auch damit Versuche an. Es ließ
sich hierdurch allerdings schon, wenn nur der vierte Theil des Essigs überdestillirt
wurde, fast der ganze Säuregehalt desselben im Destillate concentriren, allein die
Destillation ging außerordentlich langsam von statten und das Destillat enthielt
viel Salzsäure. Ich halte daher das Kochsalz, 33 Pfd. auf 100 Pfd. Essig, für das
geeignetste Material, um den Kochpunkt des Essigs zu erhöhen und seinen Säuregehalt
um ½ zu verstärken. Wenn man überdieß die übergehenden sauren Dämpfe auf
Bleiglätte einwirken
läßt, so erhält man, unter Umständen sofort, eine concentrirte Bleizuckerlösung,
welche beim Erkalten vollkommen farblose Krystalle liefert.
Dieser Erfolg tritt ein, wenn die Dämpfe bei ihrer Einwirkung auf die Bleiglätte ihre
ursprüngliche Temperatur beibehalten, also nicht abgekühlt werden. In diesem Falle
wird, wenn dieselben durch eine hinreichend hohe Schicht von feingepulverter
Bleiglätte hindurchstreichen müssen, alle Essigsäure vollständig und so viel Wasser
gebunden, als zur Lösung des gebildeten Bleizuckers erfordert wird; das übrige
Wasser entweicht in Dampfform. Werden dagegen die Dämpfe auf ihrem Durchgange durch
die Bleiglätteschicht verdichtet, oder finden sie nicht eine hinreichende Menge oder
nicht sein genug zertheilte Bleiglätte vor, so entsteht eine verdünnte Lösung,
welche dann noch abgedampft werden muß, um Krystalle zu liefern. Um die Bildung
eines basischen Bleisalzes zu vermeiden, hat man darauf zu sehen, daß die heiße
Bleizuckerlösung nicht lange mit überschüssiger Bleiglätte in Berührung bleibt, und
um große Krystalle zu erhalten, muß die abgelaufene Lösung, wie weiter vorn schon
angegeben wurde, behandelt werden. Sollte nichts desto weniger die Bildung von
basischem Salze erfolgt seyn, so setzt man eine entsprechende Menge destillirten
Essigs zu, den man zu diesem Zwecke vorräthig hält. Man setzt die Destillation
jedesmal so lange fort, bis die übergehenden Dämpfe oder der Rückstand in der
Retorte Lackmus nicht mehr röthen. Die in dem Destillirapparate zurückbleibende
Kochsalzlösung wird durch die unter demselben nicht verbrauchte Wärme, oder die
entweichenden Dämpfe leicht und ohne Kosten abgedampft werden können.
Zur Ausführung dieses Verfahrens kann der weiter unten beschriebene und durch eine
Zeichnung verdeutlichte Apparat dienen, dessen Größenverhältnisse für die
jedesmalige Production von 3 Ctr. Bleizucker berechnet sind.
3) Darstellung des Bleizuckers unter
gleichzeitiger Anwendung von rohem Essig und Essigdämpfen.
Anstatt, wie bei der unter 2) beschriebenen Methode, die Essigdämpfe direct auf
Bleiglätte einwirken zu lassen, kann man sie auch so benutzen, daß man sie in ein
Gemisch von Essig und Bleiglätte eintreten läßt. In diesem Falle werden sie
einerseits natürlicherweise durch ihren Säuregehalt eine entsprechende Menge
Bleiglätte lösen und andererseits durch ihre Wärme das Gemisch von Essig und
Bleiglätte erhitzen.
Man bringt in diesem Falle eine gewisse Menge Essig in einen offenen hölzernen
Bottich, gibt dazu so viel Bleiglätte, als derselbe seinem Säuregehalt zufolge
sättigen kann, und außerdem noch so viel, als dem Säuregehalt der Menge Essigs
entspricht, dessen Dämpfe man benutzen will. Die Destillation nimmt man in der unter
2) angegebenen Art und mit demselben Apparate vor, nur mit dem Unterschiede, daß man
die Essigdämpfe mit Hülfe einer zinnernen oder bleiernen Röhre auf den Boden des
Bottichs leitet.
Wenn man zum Uebergießen der Bleiglätte einen farblosen Essig angewendet hat, so
erhält man auf die angegebene Weise eine Bleizuckerlösung, welche nur noch durch
Abdampfen concentrirt zu werden braucht, um farblose Bleizuckerkrystalle zu liefern.
Ob aber diese Methode vortheilhaft seyn wird, da man, um eines guten Resultates
gewiß zu seyn, farblosen Essig anwenden und außerdem noch abdampfen muß, möchte ich
bezweifeln.
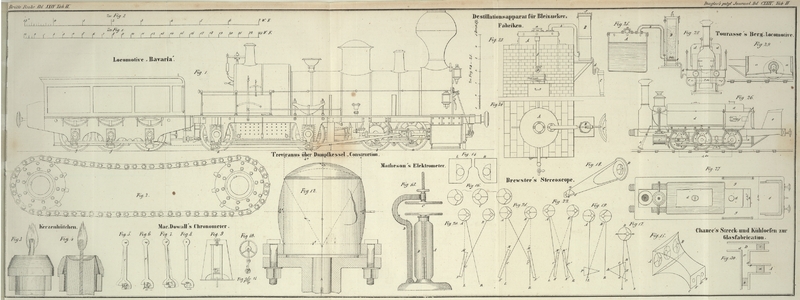
Destillationsapparat.
Dieser Apparat, in Fig. 23–25 dargestellt, besteht
aus einer kupfernen Blase A, aus welcher die Dämpfe
durch die Röhre b, welche an ihrer Mündung in B mit einer Siebvorrichtung versehen ist, in den untern
Theil des hölzernen oder irdenen, auch emaillirt eisernen Gefäßes B geleitet werden. Dieses dient zur Aufnahme der
feingepulverten und mit dem gleichen Volumen grobkörnigen Sandes (am besten
erbsengroße Kieselstücke) vermischten Bleiglätte. Bei c
ist dasselbe mit einem siebartig durchlöcherten falschen Boden versehen, auf welchem
ein Stück Filz oder Wollenzeug ausgebreitet ist, und durch den hindurch die
Bleizuckerlösung fließt, um schließlich sich durch das Rohr d in den Krystallisirbottich C zu entleeren.
Die Biegung des Rohrs d bildet einen Verschluß, der beim
Beginn der Arbeit durch wenig Wasser herzustellen ist, um die Dämpfe am Entweichen
in dieser Richtung zu hindern. Bei e ist eine Oeffnung,
welche den Wasserdämpfen einen Ausweg gestattet.
Die Blase A wird durch a,
welches mit einem aufzuschraubenden Deckel geschlossen werden kann, gefüllt; den
Stand der Flüssigkeit gibt der Index f an, der an seinem
untern Ende zugleich einen Hahn g hat, durch welchen die
Blase entleert werden kann. Hier läßt sich auch sehr leicht die Reaction des
Blaseninhaltes auf Lackmuspapier prüfen, wenn man nicht vorzieht, in der Röhre b, bei b, einen kleinen
Probehahn zur Prüfung der Dämpfe anzubringen.
Sollte befürchtet werden daß bei e noch Essigsäure mit
den Wasserdämpfen entweiche, und man vorziehen, eine weniger concentrirte
Bleizuckerlösung zu erzielen, so läßt man das Rohr b in
den obern Theil von B einmünden und am Boden von B eine gerade Röhre bis auf den Boden des
Krystallisirbottichs gehen. Dadurch erhalten die Dämpfe eine geringe Spannung und
werden vollständiger von der Bleiglätte aufgenommen.
Tafeln