| Titel: | Beiträge zur Kenntniss des Deacon'schen Processes der Chlordarstellung; von Dr. Konrad Jurisch in Widnes (England). |
| Autor: | Konrad Jurisch |
| Fundstelle: | Band 221, Jahrgang 1876, S. 357 |
| Download: | XML |
Beiträge zur Kenntniss des Deacon'schen Processes
der Chlordarstellung; von Dr. Konrad
Jurisch in Widnes (England).
Mit Abbildungen im Text und auf Tafel VIII.
Jurisch, über Deacon's Proceß der Chlordarstellung.
Als der Deacon'sche Proceß anfing, bei der englischen Industrie Eingang zu finden,
und – wegen der Aussicht auf glänzende Rentabilität – in kurzer Zeit
(1872 und 1873) in mehr als zwölf englischen und in zwei deutschen Fabriken Apparate
dafür aufgestellt wurden, war man allgemein der Ansicht, daß die mit Kupferlösung
getränkten Thonkugeln während einer sehr langen Zeit, wenigstens 1 bis 2 Jahre oder
länger, eine ununterbrochene Chlorproduction vermitteln würden. Hätte diese Hoffnung
sich erfüllt, so würde der Deacon'sche Apparat, trotz seiner großen Anlagekosten und
bei den damaligen Preisen für Chlorkalk, doch in 1 bis 2 Jahren sich mehr als
bezahlt gemacht haben.
In dieser Erwartung fing man mit wenigen Ausnahmen im J. 1873 an den verschiedenen
Plätzen fast gleichzeitig an, mit diesem Proceß zu arbeiten. Aber schon nach wenigen
Monaten liefen von allen Seiten Klagen über Klagen ein. Im J. 1874 war die günstige
Meinung über den Proceß allgemein erschüttert, und 1875 geradezu ungünstig geworden.
Seit dem Anfang des J. 1876 existiren kaum mehr als drei oder vier Fabriken in
England, welche mit dem Proceß noch arbeiten, nachdem man große Veränderungen in der
Construction des Apparates gemacht hat. Gegenwärtig verhält man sich im Allgemeinen
abwartend und versuchend, welche Gestalt dem Proceß zu geben sei, um denselben mit
Erfolg anwenden zu können.
Es ist sehr wahrscheinlich, daß man die Thonkugeln als Träger des zersetzenden Agens
ganz fallen läßt, weil die Dauer ihrer Wirksamkeit zu kurz ist, und zwar um so
kürzer, je öfter sie von neuem mit Kupferlösung getränkt worden sind, – und
weil dieses häufige Herausnehmen der Kugeln aus dem Apparate, das Tränken derselben in
Kupferlösung und Wiedereinfüllen, und die schnelle Abnützung des gesammten Apparates
den Proceß kostspieliger macht als den Weldon'schen Proceß.
Es ist nun eine interessante Aufgabe, zu untersuchen, welches die Ursachen sind,
wodurch die Thonkugeln nach einer gewissen Zeit die Fähigkeit verlieren, Chlor zu
generiren.
Die folgenden Untersuchungen wurden im Laboratorium der HH. James Muspratt and Sons in Widnes
(Lancashire) angestellt in der Absicht, diejenigen Wege aufzufinden, durch welche
sich eine Verlängerung der Activitätsdauer der Thonkugeln herbeiführen ließe.
Es hat sich herausgestellt, daß viele Fabrikanten, welche Deacon's Proceß anwendeten,
um Chlor darzustellen, in einer Periode dieses Processes, d.h. in der Zeitdauer der
Activität der mit Kupferlösung getränkten Thonkugeln, nahezu dieselbe Quantität
Chlorkalk producirten, gleichgiltig, ob sie schneller oder langsamer gearbeitet
hatten. Diese Quantität stellte sich für 120t Thonkugeln mit etwa 1 Proc. Kupfer auf rund 600t Chlorkalk. Wenn die Production sich
diesem Betrag näherte, so verminderte sich die Zersetzung der Salzsäure auf 20 bis
10 Proc., wodurch eine Unterbrechung des Processes nothwendig wurde, um den
Zersetzungsapparat mit wieder frisch getränkten Thonkugeln zu füllen.
Es scheint also eine Abhängigkeit zu bestehen zwischen der Oberfläche der Thonkugeln
und der Menge des darauf befindlichen Kupfers einerseits, und der Quantität des zu
producirenden Chlorkalkes, resp. der durch den Apparat zu schickenden Menge
Salzsäure anderseits.
Die Thonkugeln, welche in der Fabrik der oben genannten Firma im März 1875 am Ende
einer Periode aus dem Apparate genommen wurden, hatten nur wenig an Kupfer verloren
und zeigten eine rauhe Oberfläche in verschiedenen Farben. Nachdem sie einige Tage
an der freien Luft gelegen, hatten sich jedoch namentlich die größern, vom Boden der
Abtheilungen entnommenen, mit einer zähklebrigen Substanz übergezogen. Mehrere
dieser Thonkugeln wurden mit Wasser abgewaschen, die Lösung erwärmt und abfiltrirt.
Diese Lösung hatte die Farbe von Eisenchloridlösung, reagirte auf Lackmus sauer, und
ergab durch Analyse folgende Quantitäten:
g
C
4,110
BaSO₄
159,640
Fe₂O₃ und Al₂O₃
36,759
Fe₂O₃
34,659
CaCO₃
3,000
g
Cu
0,390
PbSO₄
0,260
2(NH₄, Mg, AsO₄) + H₂O
5,045
Na₂SO₄ und K₂SO₄
4,970Hierzu ist zu bemerken, daß die Thonkugeln mit einer Lösung von 3/4
G. Th. Kupfersulfat und 1/4 G. Th. Natriumsulfat getränkt waren, daß
aber Dr. Hurter bei ähnlichen Analysen Natrium auch auf Thonkugeln
gefunden hat, welche nur mit Kupferlösung getränkt worden waren, so
daß man also eine Verflüchtigung von Chlornatrium vom Sulfatofen her
annehmen muß.
K₂PtCl₆
1,500
Diese Zahlen, auf die wahrscheinlichsten Verbindungen umgerechnet, ergaben folgendes
Resultat, wobei jedoch etwa 0,44 Proc. SO₃ mehr angenommen ist, als
gefunden:
g
Proc.
Fe₂Cl₆
6,271
6,10
Fe₂S₃O12
78,930
76,77
Al2S₃O12
7,012
6,82
CaSO₄
4,080
3,97
PbSO₄
0,260
0,25
CuSO₄
0,980
0,95
Na₃AsO₄
4,332
4,22
K₃AsO₄
0,524
0,51
As₂O₅
0,423
0,41
––––––––––––––
102,812
100,00.
Der in Wasser umgelöst gebliebene Theil wurde mit Königswasser behandelt und die
Lösung vom Sand und Thon abfiltrirt. Die Analyse ergab folgende Gewichtsmengen:
g
BaSO₄
3,250
Al₂O₃
0,105
Fe₂O₃
2,203
PbSO₄
0,039
CaCO₃
0,155
SiO₂
0,200
2(NH₄, Mg, AsO₄) + H₂O
0,135
Na₂SO₄
0,764
Sb₂S₃
0,025.
Auf die wahrscheinlichsten Verbindungen umgerechnet:
g
Proc.
Al₂O₃
0,105
2,52
CaSO₄
0,211
5,05
PbSO₄
0,039
0,93
Fe₂S₃O12
1,635
39,16
––––––––––––
Uebertrag
1,990
47,66
g
Proc.
Uebertrag
1,990
47,66
Fe₂O₃
1,457
34,90
Fe₄Si₃O12
0,074
1,77
Na₄SiO₄
0,493
11,81
Fe₂As₂O₈
0,139
3,33
Sb₂O₃
0,022
0,53
––––––––––––
4,175
100,00.
Oder beide Analysen zusammengefaßt, liefern unter
Nichtberücksichtigung des Wassers folgende Zahlen das wahrscheinlichste Bild von der
Mischung der Substanz (I. Analyse):
g
Proc.
Fe₂Cl₆
6,271
5,86
Fe₂S₃O12
80,565
75,30
Al₂S₃O12
7,012
6,55
Fe₂O₃
1,457
1,36
Al₂O₃
0,105
0,10
CaSO₄
4,292
4,01
PbSO₄
0,299
0,28
CuSO₄
0,980
0,92
Na₃AsO₄
4,332
4,05
K₃AsO₄
0,524
0,49
Fe₂As₂O8
0,139
0,13
As₂O₅
0,423
0,40
Na₄SiO₄
0,493
0,46
Fe₄Si₃O12
0,074
0,07
Sb₂O₃
0,022
0,02
––––––––––––––
106,988
100,00.
Der Staub, welcher sich zwischen den Thonkugeln angehäuft hatte, während sich
dieselben noch im Zersetzungsapparat befanden, wurde ebenfalls einer Untersuchung
unterworfen, jedoch nur um die Hauptbestandtheile kennen zu lernen. Dieser Staub
hatte noch kein Wasser angezogen, und seine Farbe wechselte von hellgelb bis
schmutziggrün; eine gemischte Probe enthielt:
Proc.
Fe₂Cl₆
0,37
Fe₂S₃O12
71,70
Al₂S₃O12
5,81
CuSO₄
0,36
Na₃AsO₄
0,24
Fe₂O₃
13,64
–––––
92,12 (James Cochrane).
Das Kupfer wurde bei diesen Analysen stets in einer in Wasser löslichen Form
gefunden. In andern Fabriken, z.B. in Newcastle-on-Tyne, wo man bei
einer Temperatur von 450 bis 500° C. gearbeitet hatte, fand sich das Kupfer schließlich
in einer in Wasser unlöslichen Form von wahrscheinlich Kupferoxyd. Man benützt dort
norwegische Schwefelkiese, die wenig Arsen enthalten, so daß also auch die
Schwefelsäure reiner ist als in hiesigen Fabriken, welche irische und spanische
Kiese gebrauchen. In der hiesigen Muspratt'schen Fabrik hatte man mit einer
Temperatur von 390 bis 415° gearbeitet.
Die Salzsäure, welche sich in den ersten Kühlgefäßen aus Sandstein condensirte, wurde
ebenfalls untersucht. 4l,5 derselben (vom specifischen Gewichte 1,145) wurden
eingedampft bis zu einem steifen zähen Brei von blaß grüngrauer Farbe. Dieser Brei,
welcher in seiner physikalischen Beschaffenheit Aehnlichkeit hatte mit der Substanz,
welche die Thonkugeln überkleidete, nachdem sie einige Zeit an der Luft gelegen
hatten, wurde mit wenig Wasser behandelt, wodurch eine grüne Lösung entstand, welche
jedoch beim Verdünnen mit Wasser weißes Sb₂O₃ abschied. Die grüne
Lösung ergab bei der Analyse folgende Gewichtsmengen:
g
BaSO₄
98,400
Se
0,310
Cl
3,550
Fe₂O₃
1,463
Al₂O₃
7,973
CaCO₃
1,700
PbSO₄
0,080
Cu
0,779
Mg₂P₂O₇
2,820
SiO₂
1,220
Na₂SO₄
0,952
2 (NH₄, Mg, AsO₄) + aq
10,585
Sb₂S₃
3,382.
Der vom Wasser nicht aufgenommene Theil wurde mit Salzsäure gelöst und lieferte
folgende Mengen:
g
BaSO₄
1,960
Fe₂O₃
0,045
Al₂O₃
0,100
CaCO₃
0,428
PbSO₄
0,640
Mg₂P₂O₇
0,104
SiO₂
0,168
Na₂SO₄
0,160
2(NH₄, Mg, AsO₄) + aq
0,133
Sb₂S₃
0,036.
Diese Analyse wurde ebenfalls in zwei Theilen ausgeführt, nicht wie jene erste, um
mit einiger Sicherheit die verschiedenartigen Verbindungen nachzuweisen, sondern, da hier
ja nur einfache Chloride vorlagen, weil es sich heraus gestellt hatte, daß die
Bestimmung des Selens viel leichter und sicherer in einer wässerigen oder nur
schwach sauren Lösung vorgenommen werden kann, als in einer Lösung, die viel
Salzsäure enthält. So war auch in dem zweiten, in Salzsäure gelösten Theil noch eine
kleine Menge Selen vorhanden, deren Gewicht jedoch nicht bestimmt werden konnte.
Wenn man die in beiden Analysen gefundenen Gewichtsmengen auf die einfachsten
Chloride und Säuren berechnet, so erhält man folgendes Resultat:
g
H₂SO₄
42,192
H₂SeO₃
0,506
Fe₂Cl₆
3,064
Al₂Cl₆
23,093
PbCl
0,660
CuCl₂
1,657
CaCl₂
2,362
MgCl₂
2,412
NaCl
0,916
AsCl₃
10,239
SbCl₃
4,244
H₄SiO₄
2,181
––––––
93,526.
Oder 1l der
untersuchten Salzsäure zeigte folgende Zusammensetzung (II. Analyse):
g
H₂O
794,830
HCl
329,370
H₂SO₄H₂SeO₃Fe₂Cl₆Al₂Cl₆PbCl₂CuCl₂CaCl₂MgCl₂NaClAsCl₃SbCl₃H₄SiO₄
9,3760,1130,6815,1320,1470,3680,5250,5360,2032,2750,9430,485
20g,784.
––––––––
1l
1144,984.
Die Discussion dieser Analysen scheint nun folgende Grundsätze zu ergeben:
Da die Quantität des auf den Thonkugeln befindlichen Kupfers bis zum Ende einer
Periode nur um etwa 15 bis höchstens 25 Proc. sich verringert, so hat die
Inactivität der Thonkugeln offenbar noch eine andere Ursache, als die blose
Verflüchtigung des Kupferchlorids. Sicher trägt diese jedoch dazu bei, die
Thonkugeln in ihrer Leistungsfähigkeit zu beeinträchtigen, da ja das sich
verflüchtigende Kupfer gerade von der Oberfläche der Kugeln herstammt, die allein
als wirksam angesehen wird, während ein Ersatz des verdampften Kupfers aus dem
Innern der Thonkugel wenig wahrscheinlich ist.
Wenn die Verflüchtigung des Kupferchlorids die einzige Ursache der Inactivität der
Thonkugeln wäre, so würden dieselben noch viel länger wirkungsvoll bleiben, als es
thatsächlich der Fall ist, da sie am Ende der Periode noch keinen Mangel an Kupfer
zeigen, und der lose Staub zwischen den Kugeln, der wohl hauptsächlich durch
gegenseitiges Abreiben während des Herausnehmens entsteht, noch reich an Kupfer ist.
Und in der That, wenn man die große Menge von fremdartigen Substanzen ansieht,
welche die geringe Menge von löslichem Kupfersalz umgibt, so muß man der Vermuthung
Raum geben, daß das Kupfer einfach so dicht von unwirksamen Substanzen umhüllt ist,
daß die Salzsäuregase es nicht mehr erreichen können. Dies scheint schließlich der
Hauptgrund der Inactivität zu sein.
Es entsteht nun die Frage, welche unter den zahlreichen umhüllenden Körpern die
gefährlichsten sind? Offenbar die Sulfate von Eisenoxyd und Thonerde, weil diese in
der größten Quantität vorhanden sind. Hieran schließen sich Eisenchlorid und die
Arseniate. Man würde jedoch wahrscheinlich irren, wenn man den Einfluß dieser
letztern Verbindungen, im Vergleich mit dem Einfluß des schwefelsauren Eisenoxyds
etc., für so gering anschlüge, wie das Verhältniß der Procentzahlen in der ersten
Analyse es zu fordern scheint. Denn gerade diese Verbindungen, welche auf den
Thonkugeln nur spärlich zurückgeblieben sind, sind im Chlorstrom schon etwas unter
400° flüchtig und führen wahrscheinlich einen Theil des Kupferchlorids,
welches erst bei 468° verdampft, schon in niedrigerer Temperatur mit sich
fort. Die letzte Analyse zeigt, in welchem Verhältniß Kupferchlorid und die leichter
flüchtigen Chloride des Arsens, Antimons und Aluminiums, in der condensirten
Salzsäure sich vorfinden.
Die Hauptquelle aller dieser Verunreinigungen ist sicherlich die Schwefelsäure,
welche zur Zersetzung des Kochsalzes gebraucht wird, um einerseits Sulfat und
anderseits Salzsäuregas zu produciren. Aber aus der ersten Analyse ist man wohl
berechtigt, den Schluß zu ziehen, daß auch durch die Zersetzung der Substanz der
Thonkugeln selbst eine zweite Quelle der Verunreinigung vorhanden ist. Es ist durch Untersuchungen von
Dr. Hurter in Widnes
erwiesen, daß, besonders bei Anwendung von Ofengas, eine geringe Menge Chlornatrium
durch Verflüchtigung in den Zersetzungsapparat und damit auf die Thonkugeln gelangt,
und daß ebenso die Verunreinigungen des Kochsalzes, wie Chlorkalium und Thonerde auf
demselben Wege dorthin gelangen können. Aber diese Annahme würde noch nicht die
Zahlen der Analyse erklären. Denn das Kochsalz enthält kaum 1 Proc. KCl und weniger
als 2 Proc. Al₂O₃, während die Menge des Kaliums auf den Thonkugeln im
Verhältniß zu der des Natriums mehr als zehnmal so groß ist. Und selbst wenn man für
KCl eine leichtere Verdampfungsfähigkeit annimmt wie für NaCl, so kann die Gegenwart
einer so großen Menge von Kalium doch wohl nur durch eine Zersetzung des Thones
erklärt werden. Diese Ansicht wird noch unterstützt durch das Vorhandensein von in
Salzsäure löslicher Kieselsäure, welche also wahrscheinlich in der Form von
Singulosilicaten von der Masse des Thons abgesondert worden ist.
Der außerordentlich hohe Gehalt der Salzsäure an Al₂Cl₆ mag zum Theil
dadurch erklärt werden, daß die Gase, welche aus dem Zersetzungsapparat kommen, sich
theilweise schon in einer langen thönernen Röhre condensiren, an deren Boden die
starke Salzsäure langsam nach dem ersten Kühlgefäß abfließt; und dabei mag sie wohl
etwas Thon auflösen.
Es scheint also, daß für die bisherige Handhabung des Processes zwischen 1t Cu, welches sich auf 120t Thonkugeln befindet, einerseits und der
Menge der Verunreinigungen der Schwefelsäure und demjenigen Antheil der
Schwefelsäure, welcher in den Apparat gelangt, anderseits die Abhängigkeit besteht,
daß die 1t Cu in der oben beschriebenen
Weise inactiv gemacht wird, wenn man eine so große Menge Schwefelsäure für den
Proceß verbraucht hat, als einer Production von 600t Chlorkalk entspricht.
Um daher die Dauer der Activität der Thonkugeln, und die Benützung derselben zu
verlängern, lassen sich aus diesen Untersuchungen folgende praktische Regeln
ableiten:
1) Es würde vortheilhaft sein, die Schwefelsäure von Arsen etc. zu befreien. Denn Dr. Hurter hat gefunden, daß
bei der Zersetzung von Kochsalz mit arsenhaltiger Schwefelsäure und Erwärmen, in dem
ersten Achtel der übergehenden Salzsäure schon 50 Proc. des gesammten Arsengehaltes
der Säure enthalten ist. In der ersten Hälfte der überdestillirten Salzsäure ist
fast die ganze anwesende Arsenmenge enthalten. Die Salzmasse der Schale, bevor dieselbe nach dem Ofen
hinübergeschafft wurde, zeigte sich arsenfrei.
2) Wenn die Annahme richtig ist, daß die Inactivität der Thonkugeln schließlich
dadurch veranlaßt wird, daß das auf ihnen befindliche Kupfersalz von andern nicht
activen Substanzen umhüllt wird, so ist es augenscheinlich, daß die Wirkungsdauer
der Thonkugeln bedeutend verlängert werden würde, wenn man die Bildung von Sulfaten
des Eisenoxyds und der Thonerde, welche ja zusammen über 80 Proc. der umhüllenden
Masse ausmachen, verhinderte; denn dadurch würden letztere auf 20 bis 15 Proc.
reducirt werden.
Die am Schluß einer Periode auf den Thonkugeln befindliche Schwefelsäure kann aus
zwei verschiedenen Quellen herstammen:
Man hatte früher die Thonkugeln mit einem Lösungsgemisch von Kupfersulfat und
Schwefelsäure, oder auch von Doppelsulfat des Kupfers und Natriums und
Schwefelsäure, getränkt, damit stets Säure im Ueberschuß gegenwärtig wäre, um
namentlich die kleine Partikelchen von gebranntem Kalk, welche sich in den
calcinirten Thonkugeln vorfänden, zu sättigen und sie zu verhindern, Kupferoxyd auf
den Thonkugeln niederzuschlagen. Dieses Verfahren sollte man nun verlassen, da man
durch dasselbe die Thonkugeln gleich von vornherein mit schädlichen Sulfaten
belastet. Glaubt man durchaus eine saure Lösung des Kupfersalzes nöthig zu haben,
was noch durchaus nicht festgestellt ist, so empfiehlt es sich, Salzsäure zu nehmen.
Hierbei hat man noch den Vortheil, daß man die salzsaure Lösung schon in der Kälte
auf 1,4 specifisches Gewicht bringen kann, und daß eine kalte oder abgekühlte Lösung
dieser Art bei 10 Minuten langem Eintauchen etwa 1 Proc. Kupfer auf den Thonkugeln
zurückläßt, womit man sehr zufrieden sein kann. Auf diese Weise läßt sich die eine
Quelle der Sulfatbildung auf den Thonkugeln vermeiden.
Die andere Quelle ist natürlich die Verdampfung der Schwefelsäure in der Sulfatschale
oder im Ofen. Da muß man nun zunächst den Grundsatz aufstellen, niemals Ofengas zum
Betrieb des Deacon'schen Processes zu verwenden, und ferner, die Arbeit in der
Sulfatschale so zu leiten, daß sich möglichst wenig Schwefelsäure mit der Salzsäure
verflüchtigt. Um nun zu vermeiden, daß von der Sulfatschale schon Schwefelsäure
verdampft, könnte man das Kochsalz bei niedriger Temperatur, etwa 20 bis
100°, zersetzen. Dieses Verfahren würde aber ein viel zu langsames Arbeiten
bedingen, als daß man es ausführen könnte. Man ist genöthigt, die Sulfatschale zu
erhitzen, um das Gußeisen vor der Einwirkung der Schwefelsäure etwas zu schützen und
um eine gute Zersetzung des Kochsalzes zu erzielen, besonders aber, um schneller zu
arbeiten. Nach den
Versuchen von James Cochrane und John Gordon in der Fabrik der HH. James Muspratt and Sons in Widnes enthielt das
Gasgemenge, welches von der Sulfatschale entwich, auf je 100g HCl:
J. Cochrane.
J. Gordon.
g
g
Während die Schwefelsäure einlief
0,073 SO₃
–
Nachdem alle Säure eingelaufen ist
0,345 „
–
Während des Kochens der Charge
1,079 „
0,251 SO₃
Gegen Ende des Kochens
–
5,000 „
Beim Steifwerden
5,556 „
–
Nachdem die Charge steif geworden ist
–
8,723 „
Vor dem Hinüberschaffen nach dem Ofen
–
6,711 „
Wenn man also blos das Gas benützt, welches während der ersten Periode des
Zersetzungsprocesses entweicht, so hat man ein ziemlich reines Salzsäuregas, welches
außer Luft und etwas Wasserdampf nur ein Minimum an Schwefelsäure enthält. Als
unmittelbares Resultat dieser Betrachtung empfiehlt es sich also, mit zwei
Sulfatschalen und den dazu gehörigen Oefen zu arbeiten und die Arbeit so
einzurichten, daß man das Gas von der ersten Schale nur so lange benützt, als die
Charge noch in dünn breiartigem Zustande ist, darauf aber die Verbindung mit dem
Deacon'schen Proceß zu unterbrechen und das Gas einen andern Weg zum
Condensationsthurm zu leiten, während zu der derselben Zeit die Arbeit in der
zweiten Schale beginnt, deren Gas man nun zum Deacon'schen Proceß gehen läßt.
Während dieser Zeit mag die erste Schale nach dem Ofen hin entleert und neu
beschickt werden, um fertig zur Arbeit zu sein, sowie die Charge der zweiten Schale
ihren flüssigen Zustand verliert. Durch solche abwechselnde Arbeit ist man im
Stande, die Oefen bis zur äußersten Leistungsfähigkeit auszunützen, und hat dabei
stets ein ziemlich reines Salzsäuregas für den Deacon'schen Proceß.
Das Ofengas anzuwenden, ist durchaus verwerflich, denn dasselbe ist nicht nur mit
Schwefelsäuredämpfen überladen, sondern auch mit den meisten jener flüchtigen
Verbindungen, welche in der zur Charge nöthigen Schwefelsäure enthalten sind.
Dadurch wird einerseits die Zersetzung des Thones beschleunigt und anderseits die
Oberfläche der Kugeln mit unwirksamen Substanzen überkleidet.
3) Am Ende einer Periode dürfte es nicht zu rathen sein, die Kugeln blos aus dem
Zersetzungsapparat zu nehmen, von Neuem mit Kupferlösung zu tränken und wieder
hinein zu packen, sondern man sollte dieselben zerbrechen, um neue Oberflächen zu
schaffen, und dann erst frisch tränken. Vielleicht könnte man aber die Thonkugeln
auch in unveränderter Form wieder nutzbar machen dadurch, daß man sie in flachen Haufen mehrere Monate
lang dem Einfluß der Atmosphärilien aussetzte, um es dem Regen zu überlassen,
dieselben rein zu waschen. Natürlich müßten diese Thonkugeln vor neuem Gebrauch erst
wieder gebrannt werden.
4) Es scheint, als ob die leichte Zersetzbarkeit des Thones der Kugeln durch die
Einwirkung der glühenden Gase von schädlichem Einfluß sei – insofern, als ja
die Schwefelsäure, wenn sie kein Eisenoxyd und keine Thonerde fände, mit welchen
Basen sie sich verbinden könnte, einfach in Dampfform durch den Apparat streichen
würde und so keine Veranlassung zu einer Umhüllung des Kupfers auf den Thonkugeln
geben könnte. Hiernach würde es sich also empfehlen, zu den Kugeln einen sehr
widerstandsfähigen oder kieselsäurereichen Thon, am besten Porzellanthon,
anzuwenden. Aber die Erfahrung läßt diese Schlußfolgerung als trüglich erkennen.
Dr. Hurter hat gefunden, daß
die Quantität Chlorkalk, welche in einer Periode fabricirt werden kann, unter sonst
gleichen Bedingungen proportional dem Gehalt des Thones der Kugeln an Basis
(Eisenoxyd und Thonerde) ist. Ein hoch kieselsäurehaltiger Thon gab die schlechteste
Production. Hieraus folgt also, daß die Schwefelsäure eine doppelt schädliche Rolle
bei dem Proceß spielt – und zwar, daß sie schädlicher ist, wenn sie in
gasförmigem Zustande durch den Apparat streicht, als wenn sie durch Zersetzung des
Thones sich zu schwerflüchtigen Sulfaten verbindet und damit das Kupfer auf den
Thonkugeln nach und nach mechanisch umkleidet. Erst wenn diese Umkleidung so weit
vorgeschritten ist, daß die Schwefelsäuredämpfe des Gasgemenges keine Basis
(Eisenoxyd und Thonerde) mehr finden können, und daher dampfförmig bleiben, sinkt
die Production von Chlor so weit, daß die Thonkugeln für erschöpft gelten.
Uebrigens zeigt die Salzsäure, welche sich in den ersten Kühlgefäßen aus dem
Gasgemenge condensirt, nachdem dasselbe den Zersetzungsapparat verlassen hat, in
ihrem großen Gehalt an freier Schwefelsäure, daß nur ein sehr kleiner Bruchtheil der
Schwefelsäure, welche in Dampfform in den Proceß gelangt, von den Thonkugeln
zurückgehalten wird, während der überwiegend größere Theil den Zersetzungsapparat in
Dampfform passirt und erst nachher in den Kühlgefäßen condensirt wird.
Es ist daher eine Lebensfrage für den Proceß, entweder die Schwefelsäure ganz aus dem
Gasstrome zu entfernen, oder eine überaus große Menge Basis (z.B. das Eisenoxyd der
abgerösteten Schwefelkiese) als Träger der activen Substanz zu benützen.
Gleichzeitig mit diesen Untersuchungen hat man auf der Rhenania in Stolberg bei
Aachen ebenfalls nach den Ursachen geforscht, welche die Wirkungslosigkeit der
Thonkugeln veranlassen, und hat sehr schnell die Schwefelsäure als schädlich
erkannt. Um dieselbe aus dem Gasgemenge zu entfernen, hat R. Hasenclever vorgeschlagen, die Eigenschaft des Kochsalzes zu benützen,
auch in höherer Temperatur durch Einwirkung von Schwefelsäuredampf oder schwefliger
Säure, welche mit Luft vermischt ist, in Sulfat überzugehen, – welche
Eigenschaft ja in dem Hargreaves'schen Proceß so ausgedehnte Anwendung findet.
In England hat man es vorgezogen, die Schwefelsäuredämpfe auf nassem Wege, durch
partielle Condensation der Dämpfe, ehe sie in den Erhitzungsapparat eintreten, aus
dem Gasgemenge zu entfernen, wodurch man zugleich den Vortheil hat, den Gehalt der
Gase an Wasserdampf zu verringern; denn Wasserdampf spielt in diesem Proceß
ebenfalls eine höchst nachtheilige Rolle.
Beim gewöhnlichen Condensations- und Waschthurmsystem, wo es darauf ankam, die
Salzsäure möglichst vollständig zu condensiren, enthielt nach Versuchen von John Gordon in der Muspratt'schen Fabrik zu Widnes die
Salzsäure aus einem Condensationsthurm von 1,138 spec. Gew. 6g,7 H₂SO₄ im Liter, aus einem
andern Condensator von 1,128 spec. Gew. 5g,06 H₂SO₄ im Liter, während die aus dem Waschthurm abfließende
Säure von 1,040 spec. Gew. nur 0g,42
H₂SO₄ im Liter enthielt. Bei der ausgezeichneten Verdichtung, wie sie
im Condensator und Waschthurm stattfindet, kann man also annehmen, daß etwa 93 Proc.
der gesammten Schwefelsäure schon im ersten Thurme condensirt werden. Aber mit
diesen 93 Proc. der Schwefelsäure ist auch der größte Theil der Salzsäure
condensirt, und man würde mit so verdünntem Salzsäuregas keinen lohnenden Betrieb
des Deacon'schen Processes herstellen können. Die Condensation müßte also
nothwendiger Weise sehr viel unvollständiger veranlaßt werden, und es ist sehr die
Frage, ob dann das Gas genügend von Schwefelsäure befreit werden würde, um die
Chlorproduction nicht zu beeinträchtigen.
Um nun die Schlußfolgerungen aus den Analysen der Substanzen, welche sich am Ende
einer Periode auf den Thonkugeln vorfinden, in Bezug auf den Einfluß der
Schwefelsäure auf die Wirksamkeit der Thonkugeln auch experimentell als richtig
nachzuweisen, wurden im Laboratorium der HH. James Muspratt and Sons in Widnes im April 1875
folgende directe Versuche angestellt.
Skizze des zu den Experimenten benützten Apparates.
Textabbildung Bd. 221, S. 368
1. Versuch: Eine Verbrennungsröhre wurde in der Länge von
254mm mit 23g,5 kleiner Thonkugelstücken angefüllt, die
in einer heiß gesättigten und mit Schwefelsäure stark angesäuerten Lösung von
Kupfersulfat getränkt worden waren, und welche 2,5 bis 3 Proc. Kupfer enthielten.
Das erforderliche Chlorwasserstoffgas wurde durch Zersetzung von Kochsalz mit
Schwefelsäure in einem Glaskolben A entwickelt. Eine
Woulf'sche Flasche B mit drei Hälsen diente dazu, das
Chlorwasserstoffgas mit einem gleichen Volum Luft zu mischen; durch zwei der Hälse
führten gleich lange Glasröhren bis nahe auf den Boden, wo sie durch Salzsäure
abgesperrt waren. Durch das eine Glasrohr wurde das Chlorwasserstoffgas, und durch
das andere atmosphärische Luft eingeleitet, deren Pressung durch ein Gasometer C stets derart regulirt wurde, daß in derselben Zeit aus
beiden Röhren gleichviel Blasen hervortraten. Das Gasgemenge strömte durch den
dritten Hals der Woulf'schen Flasche in den einen Schenkel eines Gabelrohres D, dessen anderer Schenkel vorläufig mit einem
Quetschhahn verschlossen blieb. Der Haupttheil des Gabelrohres führte das Gasgemenge
direct in die Verbrennungsröhre E und durch einen
Asbestpfropfen e auf die Thonkugelstücke, die am hintern
Ende ebenfalls durch einen losen Asbestpfropfen e'
begrenzt waren. Aus der Zersetzungsröhre trat das Gasgemenge in ein gabelförmiges
Rohr F über, dessen einer Schenkel in eine Reihe von
drei Absorptionsflaschen G führte, von denen die letzte,
wenn nöthig, mit einem Aspirator H verbunden werden
konnte. Der andere Schenkel diente dazu, die Gasproben bei K zu ziehen.Nöthigenfalls wird der Schlauch x der
Absorptionsflasche K mit dem Schlauch x zum Aspirator H
verbunden.
Diese Gasproben wurden in der folgenden Weise ausgeführt: Man hat in dem Gasgemenge
von Chlor, Chlorwasserstoff, Wasserdampf, Stickstoff und Luft, die Quantitäten der
beiden ersten Körper zu bestimmen, und erreicht dies am leichtesten durch Absorption
in Kalilauge. Zwei kleine Absorptionsflaschen, von denen jede etwa 150cc faßt, werden hinter einander verbunden;
die erste erhält etwa 100cc
Normalkalilauge, welche man etwas verdünnt und mit Lackmustinctur blau färbt, und
die zweite etwa 50cc Kalilauge, die man bis
etwa zur halben Höhe der Flasche verdünnt. Nun läßt man das zu untersuchende Gas
langsam durchstreichen, wobei alles Chlor und Salzsäuregas absorbirt werden. Sowie
die blaue Lackmusfärbung in der ersten Flasche verschwindet, ersetzt man diese
beiden Absorptionsflaschen durch zwei neue von derselben Art.
Da es bei dem vorliegenden Versuch nicht darauf ankam, die Volumprocente an Chlor und
an Salzsäuregas zu ermitteln, sondern nur die Größe der Zersetzung in Gewichtsprocenten der
durchgeleiteten Salzsäure zu finden, so wurde das Volum des durchgezogenen Gases
nicht gemessen. Die Zeitdauer einer solchen Probenahme richtet sich natürlich nach
dem Gehalt des Gasgemenges an Salzsäure und Chlor. Im Großen, wo man mit etwa 25
Vol. Proc. Chlorwasserstoffgas arbeitet, dauert die Probenahme im Durchschnitt 20
Minuten, beim vorliegenden Versuch aber nur etwa 10 Minuten im Mittel. – Zur
weitern Untersuchung spült man die Inhalte beider Absorptionsflaschen in einen
Meßcylinder und verdünnt die Flüssigkeit bis auf 250cc.
Die Menge des oxydirenden Chlors, welches in der Gestalt von unterchlorigsaurem oder
von chlorsaurem Kali vorhanden ist, findet man durch Eisenoxydulsalz in salzsaurer
Lösung und Titration des überschüssigen Eisensalzes mit Supermanganatlösung (3g, 16 KMnO₄ im Liter). 25cc aus den 250cc oxydiren gewöhnlich zwischen 0,5 und
2g Doppelsulfat von
Eisenoxydul-Ammoniak (Moleculargewicht = 392). 1g dieses Eisensalzes bedarf zu
vollständiger Oxydation zu Eisenoxydsalz 0g,09 Chlor, genauer 71/784.
Die Gesammtmenge des Chlors findet man durch Titration mit
Zehntelnormal-Silberlösung, und zwar nach zwei Methoden: Ist die zu
untersuchende Flüssigkeit neutral oder nur schwach alkalisch, so kann man
chromsaures Kali als Indicator anwenden und sofort titriren, nachdem man die Probe
ein wenig aufgekocht hat, um das etwa vorhandene unterchlorigsaure Salz in Chlorat
überzuführen. – Ist die Flüssigkeit aber stark alkalisch, so ist es sicherer,
alle Sauerstoffsalze des Chlors mit schwefliger Säure zu reduciren, den Ueberschuß
an SO₂ durch Kochen zu verjagen, etwas Salpetersäure hinzuzufügen, ein
Eisenoxydsalz als Indicator zu benützen und mit Zehntelnormal-Rhodankalium
und Zehntelnormal-Silberlösung zu titriren. 10cc oder 5cc aus den 250cc sind für diese Bestimmung genügend.
Wählt man die erste Methode mit Chromatlösung als Indicator, so erhält man durch die
verbrauchte Silbermenge die Menge des Chlors in der Form von Chloriden, während das
chlorsaure Salz unverändert bleibt. Da nun chlorsaures Kali bei der Zersetzung durch
Salzsäure die Gesammtmenge Chlor, welche zu seiner Herstellung nöthig war, nämlich
die sechsfache Menge des in ihm enthaltenen, wieder als oxydirendes Chlor in
Freiheit setzt, so hat man 1/6 der durch Eisensalz gefundenen Menge oxydirenden
Chlors zu der durch Titration mit Silberlösung gefundenen Menge Chlor zu addiren, um
die wahre Gesammtmenge des Chlors in der Flüssigkeit zu erhalten.
Wählt man die zweite Methode mit Eisenoxydsalz und Rhodan-Kalium in salpetersaurer Lösung, so
erhält man sofort die wahre Gesammtmenge des Chlors. Diese gibt nun, zu der Menge
des oxydirenden Chlors in die Proportion von 100 : x
gesetzt, in x die Procente der
Zersetzung. Man kann diese abgekürzte Rechnung anstellen, da ja diese
beiden Quantitäten Chlor in demselben Gewichtsverhältniß zu einander stehen, wie die
entsprechenden Quantitäten Chlorwasserstoff, aus denen sie herstammen.
Vor Beginn des Versuches wurden die Thonstücke in der Verbrennungsröhre durch
vorsichtiges Anheizen im Verbrennungsofen, von hinten anfangend, etwa eine Stunde
lang getrocknet und die Hitze langsam bis zur dunklen Rothglut gesteigert. Dann
wurde angefangen, Salzsäure und Luft durchzuleiten, wobei die Geschwindigkeit so
viel wie möglich constant gehalten wurde, etwa entsprechend 3 bis 4 Luftblasen auf
ebensoviel Chlorwasserstoffblasen in der Secunde. Zugleich wurde die erste Probe
angefangen, während der andere Weg durch einen Quetschhahn geschlossen wurde.
Nachdem die ersten sechs Proben gezogen waren, wurden mittels des ersten Gabelrohres
D Schwefelsäuredämpfe aus einer Kochflasche D' mit siedender concentrirter Schwefelsäure eingeführt.
Nun wurden ebenfalls sechs Proben hinter einander genommen, dann eine Pause von 25
Minuten gemacht, während welcher die Schwefelsäureeinführung unterbrochen und wieder
blos Chlorwasserstoffgas und Luft durchgeleitet wurde. Darauf wurden wieder zwei
Gasproben gezogen, und schließlich, nachdem nochmals Schwefelsäuredampf eingeleitet
und zwei Proben genommen waren, der Versuch beendet. Die Tabelle a S. 372 gibt eine Uebersicht der Resultate dieses
ersten Versuches.
Es ist sehr schwer, den Gasstrom mit dem beschriebenen einfachen Apparate constant zu
halten, da die Entwicklung des Chlorwasserstoffes ungleichmäßig vor sich geht. Es
wurde jedoch viel Sorgfalt darauf verwendet, wenigstens die Mischung mit Luft in
entsprechender Weise zu verändern, so daß stets ein Gasgemenge von etwa 50 Vol.
Proc. HCl in die Zersetzungsröhre eintrat. Gewisse Zufälligkeiten waren dabei jedoch
nicht ausgeschlossen. Für ganz kurze Zeiten mag bedeutend mehr Chlorwasserstoff, in
andern bedeutend mehr Luft eingeführt worden sein.
Aus der Gesammtmenge Chlor, welche in jeder Probe gefunden wurde, ist das Volum des
durchgezogenen Gasgemisches berechnet unter der Annahme, daß 1l HCl bei der Temperatur, mit welcher das
Gasgemenge die Absorptionsflaschen passirte, etwa 20 bis 30°, 1g,5 wiege, und daß das Gasgemenge beim
Eintritt in den Zersetzungsapparat 50 Vol. Proc. HCl enthalte.
Tabelle a.
Textabbildung Bd. 221, S. 372
Nummer der Probe; Zeitdauer in
Minuten; Gesammten-Chlormenge; Menge des oxydirenden Chlors; Zersetzung
Schwefelsäure; Pause von
Tabelle b.
Textabbildung Bd. 221, S. 372
Nummer der Probe; Zersetzung; Volum
der durchgeleiteten Gasmenge; Geschwindigkeit pro Secunde des Gasstromes in der
Verbrennungsröhre; Volum des durchgeleiteten Gasgemenges, berechnet auf 10
Minuten
Die Geschwindigkeit des Gasstromes endlich wurde berechnet unter der Annahme, daß das
Gasgemenge beim Passiren der rothglühenden Thonkugeln sein Volum verdoppele, und daß
man die Volumverminderung des freien Inhaltes der Verbrennungsröhre durch die
Thonkugelstücke vernachlässigen könne (vgl. Tabelle b S.
372).
Die ersten sechs Proben zeigen eine mittlere Zersetzung von nahezu 40 Proc.; sowie
Schwefelsäuredampf eingeführt wird, fällt die Zersetzung auf 14 1/2 Proc., im Mittel
aus sechs Proben, herab und hört sogar fast ganz auf. Diese Erscheinung kann nun,
wenn man von einer etwaigen Unregelmäßigkeit in der Entwicklung von Wasserdampf aus
der Schwefelsäure und dem Kochsalz absieht, durch sechs verschiedene Ursachen
hervorgebracht worden sein:
1) Durch die Vermehrung der in der Zeit von 10 Minuten durchgeleiteten Gasmenge von
1l,79 auf 7l, oder, was so ziemlich dasselbe sagen
will, durch die Vergrößerung der Geschwindigkeit des Gasstromes von 0m,052 auf 0m,215 in der Secunde.
2) Durch die dadurch bewirkte Abkühlung der Thonkugelstücke.
3) Durch unzureichende Zumischung von Luft.
4) Durch Verflüchtigung von Kupferchlorid.
5) Durch die Gegenwart der Schwefelsäuredämpfe im Gasgemenge.
6) Durch die Bildung von inactiven Sulfaten auf den Thonkugelstücken, welche das
darauf befindliche Kupfersalz umkleiden.
Zu den Sätzen 1 und 2 ist zu bemerken, daß allerdings mit einer Vermehrung der in der
Zeiteinheit durch den Apparat geleiteten Gasmenge eine Verminderung der Zersetzung
erfolgt, daß letztere aber durchaus nicht durch diesen Umstand allein bedingt ist.
Die Proben 2 und 5 zeigen dieselbe Zersetzung, obgleich in letzterer etwa 3 1/2 mal
soviel Gas in der Zeiteinheit durch den Apparat gegangen ist als in der erstern. Die
Probe 8 zeigt eine bessere Zersetzung als die Probe 7, trotzdem die
Geschwindigkeiten der Gase sich beinahe verhalten wie 2 : 1.
Wenn durch Vergrößerung der Geschwindigkeit des Gasstromes eine Verminderung der
Zersetzung erfolgt, so ist dieselbe meistens nur unbedeutend, da bei schnellerm
Gasstrome die bis zu einer gewissen Grenze heftigere chemische Action dahin neigt,
die Temperatur der Thonkugeln zu erhöhen und dadurch den Nachtheil der schnellern
Bewegung einigermaßen auszugleichen.
Ob trotzdem in dem vorliegenden Falle eine Abkühlung der Thonkugelstücke stattfand,
mag dahin gestellt bleiben; jedenfalls kann sie vernachlässigt werden, da man Sorge
trug, die Hitze des Verbrennungsofens zu erhöhen, sowie der Gasstrom stärker wurde.
Außerdem hat während der
Dauer dieser sechs Proben eine ziemlich lebhafte Verflüchtigung von Kupferchlorid
stattgefunden, ein Beweis dafür, daß die Temperatur der Thonkugeln keineswegs so
tief gesunken war, um daraus eine Abnahme der Zersetzung von 40 auf 15 Proc. zu
erklären.
(3). Eine unzureichende Zumischung von Luft wurde zu vermeiden gesucht, doch mag sie
wohl für kurze Zeiten stattgefunden haben. Wenn ein derartiger Vorgang bemerkt
wurde, so wurde ein daraus entspringender Fehler durch reichlichere Zuführung von
Luft wieder ausgeglichen so daß man wohl annehmen darf, daß sich die Einflüsse einer
zu spärlichen und einer zu reichlichen Luftbeimischung gegenseitig compensirten,
wenigstens so weit es die Genauigkeit des Mittlern Resultats aus sechs Proben
betrifft.
(4). Die Verflüchtigung des Kupferchlorids fand während der Dauer des Experimentes in
der aus Tabelle a S. 375 ersichtlichen Weise statt.
Bestimmbare Mengen Kupfer wurden überhaupt nur in den ersten zehn Proben
gefunden.
Vor dem Versuche befanden sich auf den 23g,5
angewendeter Thonkugeln 2,5 bis 3 Proc. Kupfer. Nach Beendigung des Experimentes
fand sich auf denselben an Kupfer die in Tabelle b S.
375 verzeichnete Menge noch vor.
Am Schluß der sechsten Probe sind 39 Proc. von der Gesammtmenge Kupfer verflüchtigt,
also noch 61 Proc. übrig geblieben. Angenommen nun, die 32,62 Proc. Cu, welche sich
am Schluß des Versuches am Ende der Röhre vorfanden, seien auch schon zu 3/4, d.h.
24,5 Proc. während dieser ersten sechs Proben nach dorthin verdampft, so bleiben von
den 61 Proc. noch 36,5 Proc. Kupfer als wirksam auf den Thonkugeln zurück, oder
0,993 Proc. vom Gewicht der Thonkugeln – ein Gehalt an Kupfer, welcher
berechtigt, eine sehr gute Zersetzung zu erwarten, besonders da man bis jetzt nur
reines verdünntes Salzsäuregas durch den Apparat hatte strömen lassen.
Die Verflüchtigung des Kupferchlorids kann demnach nicht als eine Ursache der
schlechtern Zersetzung während der Proben 7 bis 12 angesehen werden.
(5) und (6). Nachdem von allen übrigen Ursachen mit ziemlicher Wahrscheinlichkeit
nachgewiesen ist, daß man aus ihnen ein Fallen der Zersetzung von 40 auf 15 Proc.
nicht begründen kann, erscheint mit derselben Wahrscheinlichkeit die Schlußfolgerung
als richtig, daß die unter 5 und 64 und 5 angeführten Ursachen diese obenerwähnte Erscheinung hervorgebracht haben.
Da nun ein Sinken der Zersetzung von dem Augenblick ab eintrat, wo
Schwefelsäuredämpfe mit dem Gasstrome vermischt wurden, und zwar von 39,72 auf
13,72 Proc., so ist augenscheinlich eine Umhüllung des Kupfers auf den Thonkugeln
durch unwirksame Sulfate als Veranlassung dazu ausgeschlossen.
Tabelle a.
Textabbildung Bd. 221, S. 375
Nummer der Probe; Quantität des
verflüchtigten Kupfers; Procent vom Gewicht der angewendeten Thonkugeln; Procent
vom Gewicht der anfänglich auf d. Thonkugeln befindlichen Kupfermenge
Tabelle b.
Ort und Beschaffenheit.
Auf 23g,5
Thonkugelnbezogen:
Auf die Gesammtmengedes vorhandenen
Kupfersbezogen:
Proc.
Proc.
Auf den Thonkugeln, in Wasser löslichEbenda, in
HCl löslichAm Ende der Verbrennungsröhre am
AsbestpfropfenIn den Absorptionsflaschen der ersten
6 ProbenIn den Absorptionsflaschen der sechs
folgenden Proben
0,3200,0900,8901,0590,369
11,73 3,30 32,62 38,82 13,53
Im Ganzen
2,728
100,00
Die eigentliche Ursache des schnellen Fallens der Zersetzung
bleibt also bei der Schwefelsäure, welche in Dampfform mit den übrigen Gasen
gemischt durch dieZwischenräume der Thonkugeln sich fortbewegt. Aber welche Rolle spielt nun
dabei die Schwefelsäure?
Die Ansichten der HH. Hasenclever und Sartori, des Chemikers an der Rhenania, welche wohl das
Verdienst beanspruchen dürfen, eine richtige Erklärung der vorliegenden Erscheinung
gefunden zu haben, gehen nun dahin, daß der Schwefelsäuredampf im Contact mit
schwach glühender schwefelsaurer Thonerde, wie sie sich auf den Thonkugeln findet,
in Schwefligsäureanhydrit, Wasserdampf und Sauerstoff gespalten wird, – daß
die so entstandene schweflige Säure auf Kosten des freien Chlors sofort wieder
oxydirt wird, wiederum sich spaltet, und so einen verderblichen Kreislauf in dem
Zersetzungsapparat durchmacht, welcher die Chlorproduction schädigt, oder ganz
verhindert.
2. Versuch. Da bei dem eben beschriebenen Experiment es
nicht gelang, nachdem die erste Schwefelsäureeinführung unterbrochen worden war,
noch eine genügende Zersetzung zu erzielen, und die wenigen Proben 13 bis 16 keine
Schlußfolgerungen gestatteten, so wurde im April 1875 ein neues Experiment
angestellt, in der Absicht, unter sonst möglichst constanten Bedingungen mehrere
Male die Schwefelsäureeinführung zu unterbrechen und wieder reines
Chlorwasserstoffgas mit Luft gemengt durch den Apparat zu leiten. Um die lästige
Verflüchtigung des Kupferchlorids ganz zu vermeiden, wurde bei niedrigerer
Temperatur gearbeitet; dafür aber, um eine mehr gleichmäßige Wärme in der ganzen
Verbrennungsröhre zu erzielen, wurde dieselbe mit einer starken Kupferhülse umgeben.
Im Uebrigen war der Apparat genau in derselben Weise eingerichtet wie früher.
Um den Einfluß der Schwefelsäure diesmal sicherer zu studiren, wurden die
Thonkugelstücke in einer concentrirten Lösung von Kupfersulfat getränkt, welche
durch reichlichen Zusatz von Salzsäure in dunkelgrüne Kupferchloridlösung
übergeführt worden war. 34g,18 der so
getränkten Thonstücke enthielten nach dem Trocknen folgende Quantitäten löslicher
Substanzen:
In Wasser löslich.
In HCl löslich.
Zusammen.
Proc.
Proc.
Proc.
Cu
2,14
: 63
1
0,279
1
2,42
1
SO₃
3,27
: 80
1,2
0,530
1,5
3,80
1,26
Cl
1,62
: 35,5
1,35
–
–
1,62
1,2
Fe₂O₃
0,69
: 160
0,13
2,540
3,6
3,23
0,5
Zu dem Versuche wurden ebensolche Thonstücke verwendet, welche nur nach dem Trocknen
noch einmal in dieselbe Kupferlösung getaucht worden waren, um noch mehr Kupfer auf
ihnen anzuhäufen. Wenn das Verhältniß der relativen Anzahl der Molecüle von Kupfer
und Schwefelsäure von 1 : 1/4 dadurch verändert wurde, so ging man von der Annahme
aus, daß diese Veränderung so klein wäre, daß sie vernachlässigt werden könnte.
Die Temperatur der Verbrennungsröhre wurde möglichst constant auf etwa 400°
gehalten. Der Gasstrom wurde mit großer Sorgfalt, so weit es der einfache Apparat
erlaubte, derart geregelt, daß stets ein Gemenge von 50 Vol. Proc. Luft und 50 Vol.
Proc. Chlorwasserstoffgas in den Apparat gelangte. Um dies zu ermöglichen, mußte
natürlich mitunter die Geschwindigkeit ganz bedeutend verändert werden.
Während der ganzen Dauer des Versuches von 4 Stunden 35 Minuten wurde Probe nach
Probe genommen. Folgende Tabelle gibt eine Uebersicht der gewonnenen Resultate:
Textabbildung Bd. 221, S. 377
Nummer der Probe; Zeitdauer in
Minuten; Totale Chlormenge; Menge des oxydirenden Chlors; Zersetzung;
Bemerkungen; Chlorwasserstoffgas und Luft allein; Das beim Aspirator
ausgeflossene Wasser gemessen; Hier wurde Schwefelsäuredampf eingeführt;
Temperatur unverändert; HCl und Luft allein; Dämpfe von
H₂SO₄ eingeleitet; HCl und Luft allein. Hitze verstärkt; Kein Cu
verflüchtigt
Während der ersten 8 Proben wurde ein Gasgemenge, welches nur Luft und
Chlorwasserstoffgas enthielt, eingeleitet. Bei der 4. Probe wurde, so gut es sich in
der Eile machen ließ, das durchgezogene Gasvolum mittels des Aspirators annähernd
gemessen. Es wurde während der Probe ungefähr 1l Wasser auslaufen gelassen.
Angenommen nun, daß 1l Chlorwasserstoffgas
bei der Temperatur der Absorptionsflaschen 1g,5 wiege, so berechnet sich die gefundene Gesammtmenge des Chlors von
2g,609 auf etwa 1l,75 Chlorwasserstoffgas. Vernachlässigt
man das Volum des Wasserdampfes, welcher ja ebenfalls absorbirt worden ist, so würde
– da 1l Wasser aus dem Aspirator
abgelaufen ist – das durchgezogene Gasvolum also 2l,75 betragen haben mit etwa 63 Vol. Proc.
HCl. Aus dieser oberflächlichen Berechnung erklärt es sich, daß während der vierten
Probe und der folgenden 5., 6. und 7. Probe, während denen ein ähnliches
Mischungsverhältniß des Gasgemenges stattgefunden haben mag, die Zersetzung bis auf
22,09 Proc. sinken konnte; denn während der 4. Probe war augenscheinlich schon ein
Mangel an Luft vorhanden, welcher sich noch gesteigert haben mag.
Um aber für alle übrigen Proben, während denen das durchgezogene Gasvolum nicht
gemessen werden konnte, ein gleiches Maß zu haben, wurde angenommen, daß jene 1l,75 HCl der 4. Probe mit ebenfalls 1l,75 Luft gemengt gewesen, daß also während
der Probe 3l,50 durch den Apparat gegangen
wären.
Die Geschwindigkeit des Gasstromes in der Verbrennungsröhre wurde berechnet unter der
Annahme, daß das Gasgemenge in Berührung mit den 400° heißen Thonstücken sich
auf etwa 300° erwärmte, also sein Volum geradezu verdoppelte.
Unter Vernachlässigung des Volums der Thonkugelstücke, enthielt die Verbrennungsröhre
1l in 6m,147 Länge. Hieraus berechnet sich die
Geschwindigkeit des Gasstromes in der Verbrennungsröhre, z.B. während der 4. Probe
auf 0m,071 in einer Secunde. In ähnlicher
Weise sind alle Proben berechnet, wie die Tabelle auf S. 379 zeigt.
Die Resultate dieses letzten Versuches dürfen wohl Beweiskraft für die Schädlichkeit
der Schwefelsäuredämpfe in diesem Proceß beanspruchen. Die mittlere Zersetzung aus 8
Proben von 45,48 Proc. sinkt auf 21,35 Proc. als Mittel aus acht Proben herab, sowie
Schwefelsäuredampf eingeführt wird. Zwar ist die Geschwindigkeit des Gasstromes
dabei auf das 1 5/8 fache erhöht, aber die dadurch hervorgebrachte Verschlechterung
der Zersetzung könnte sich nicht in dem hohen Grade bemerkbar machen. Sowie die
Zumischung von Schwefelsäuredampf unterbrochen wurde, stieg die Zersetzung sofort auf 52,03 Proc. im
Mittel aus vier Proben. Die Geschwindigkeiten des Gasstromes während der Proben Nr.
13 und Nr. 17 waren fast dieselben, die Zersetzung aber während der letztern mehr
als doppelt so hoch wie in der erstern.
Textabbildung Bd. 221, S. 379
Nummer der Probe; Procent der
Zersetzung; Absol. Volum des durchgezogenen Gasgemenges; In der Zeit von 10 Min.
durchgezogenes Gasvolum; In der Zeit von 10 Min. durchgezogene
Gesammtchlormenge; In der Zeit von 10 Min. producirte freie Chlormenge;
Geschwindigkeit pro Sec. d. Gastromes in der Verbrennungsröhre
Eine erneuerte Einführung von Schwefelsäuredampf brachte die Zersetzung sofort von 52
auf 25 Proc. im Mittel aus drei Proben herab.
Um nun zu erfahren, ob die Thonkugeln durch die Einwirkung der Schwefelsäure an
Wirksamkeit Einbuße erlitten hatten, wurde wiederum reines Chlorwasserstoffgas, mit
50 Vol. Proc. Luft gemengt, in den Apparat geleitet. Die Hitze wurde ein wenig
verstärkt, doch nicht so sehr, daß Kupferchlorid sich verflüchtigen konnte; die
Zersetzung stieg wieder auf 40 Proc. im Mittel aus drei Proben. Die mittlere
Geschwindigkeit des Gasstromes war größer, als diejenige während der Proben 9 bis 16 und 21 bis 23,
und für gleiche Geschwindigkeiten während der Proben 14 und 26 wurde in der letztern
eine 2 1/2 mal so hohe Zersetzung beobachtet wie in der erstern. Während der Probe
Nr. 24 war die Geschwindigkeit fast doppelt so groß, als während der Probe 22, und
trotzdem war die Zersetzung mehr als doppelt so groß.
Der Einwand, daß die Temperatur der Thonkugeln während der drei letzten Proben
gesteigert worden war, ist wohl hinfällig, da eine daraus entspringende Begünstigung
der Zersetzung durch die lange Zeitdauer, während welcher die Thonkugeln Chlor
generirten, ausgeglichen wird. Da bis jetzt noch keine Verflüchtigung von
Kupferchlorid stattgefunden hatte, so ist anzunehmen, daß der Apparat am Schluß des
Versuches im Stande war, bei mäßiger Steigerung der Temperatur, noch mehrere Stunden
lang Chlor zu entwickeln.
Nachdem die Verbrennungsröhre erkaltet, und aus der umkleidenden Kupferhülse
herausgenommen war, wurden an den Thonkugeln folgende Veränderungen wahrgenommen: Im
vordern Theil der Röhre sahen die Thonkugeln weiß aus; sie wurden herausgenommen und
ihr Gewicht zu 63g,75 gefunden. Dieselben
enthielten an löslichen Substanzen:
In Wasser löslich.
In HCl löslich.
Zusammen.
Proc.
Proc.
Proc.
Cu
1,28
: 63
1
1,20
1
2,48
1
SO₃
2,35
: 80
1,5
0,44
0,28
2,79
0,9
Fe₂O₃
1,00
: 160
0,3
3,33
1
4,33
0,7
Im hintern Theil der Röhre sahen die Kugeln roth aus, und enthielten in den
Zwischenräumen krystallisirtes Kupferchlorid in braunen filzigen Krystallmassen. Der
ganze Inhalt herausgenommen, wog 16g,4 und
ergab folgende Quantitäten von löslichen Substanzen:
In Wasser löslich.
In HCl löslich.
Zusammen.
Proc.
Proc.
Proc.
Cu
3,53
: 63
1
0,46
1
3,99
1
SO₃
3,30
: 80
0,71
0,72
1,2
4,02
0,79
Fe₂O₃
1,70
: 160
0,2
1,60
0,13
3,30
0,3
Darauf wurde die nunmehr leere Verbrennungsröhre mit Salzsäure ausgewaschen und ergab
noch, auf die Gesammtmenge der benützten Thonkugeln von 80g, 15 berechnet, an löslichen
Substanzen:
Proc.
Cu
0,35
: 63
1
SO₃
0,08
: 80
0,2
Fe₂O₃
0,075
: 160
0,1
Mithin enthielten die zum Versuch verwendeten 80g,15 Thonkugeln am Schluß derselben an löslichen Substanzen:
In Wasser löslich.
In HCl löslich.
Zusammen.
Proc.
Proc.
Proc.
Cu
1,74
: 63
1
1,40
1
3,14
1
SO₃
2,55
: 80
1,2
0,57
0,32
3,12
0,8
Fe₂O₃
1,15
: 160
0,25
3,045
0,9
4,12
0,52
Da während des Experimentes keine Verflüchtigung von Kupferchlorid nach außerhalb des
Verbrennungsrohres stattfand, so hatten die Thonkugeln also am Anfang des Versuches
einen Gehalt von 3,14 Proc. Kupfer, gleichmäßig über die ganze Länge der Röhre
vertheilt. Bei Voraussetzung derselben Verhältnisse, wie sie bei 2,41 Proc.
ursprünglichem Kupfergehalt gefunden waren, ergab sich für die benützten Thonstücke
vor dem Experiment folgende Tabelle:
In Wasser löslich.
In HCl löslich.
Zusammen.
Proc.
Proc.
Proc.
Cu
2,77
: 63
1
0,362
1
3,14
1
SO₃
4,24
: 80
1,2
0,687
1,5
4,93
1,26
Fe₂O₃
0,895
: 160
0,13
3,295
3,6
4,19
0,5
Das Verhältniß der relativen Anzahl der Molecüle von Cu : SO₃ :
Fe₂O₃ war vor dem Versuch 1 : 1,26 : 0,5 und nach dem Versuch 1 : 0,8
: 0,52. Während also das Verhältniß zwischen Cu und Fe₂O₃ ziemlich
constant blieb, hat zwischen Cu und SO₃ eine Verschiebung stattgefunden, und
zwar ist offenbar die Quantität SO₃ verringert worden, nämlich von 4,93 auf
3,12 Proc. Aber in welcher Weise?
In dem vordern Theil der Röhre zeigte sich auf den 63g,75 Thonkugeln an in Wasser löslichem Cu
und SO₃ ein absoluter Verlust, und zwar von 2,77 und 4,24 Proc. auf 1,28 und
2,35 Proc., und eine relative Zunahme von SO₃ von 1,2 auf 1,5.
An in Salzsäure löslichen Substanzen machte sich eine absolute und relative Zunahme
an Kupfer bemerkbar von 0,362 auf 1,2 Proc. und eine ebensolche Abnahme an SO₃ von 0,687 auf
0,44 Proc. oder von 1,5 auf 0,28; d.h. also, es hat eine Verflüchtigung des
Kupferchlorids sowie der Schwefelsäure stattgefunden, und zwar hat sich die
Schwefelsäure ein wenig schneller verflüchtigt als das Kupferchlorid. Zu gleicher
Zeit haben sich etwas mehr lösliche Sulfate gebildet. Es sieht so aus, als ob der
Thon hier etwas gelockert worden sei; denn es ist eine absolute Zunahme an löslichem
Fe₂O₃ von 4,19 auf 4,33 Proc. zu bemerken, und zwar auch eine relative
an in Wasser löslichem von 0,13 auf 0,3, während die relative Menge des in Salzsäure
löslichen Fe₂O₃ von 3,6 auf 1 sich vermindert hat. Es gewinnt daher
den Anschein, als ob das locker mit dem Thon vermischt gewesene Eisenoxydhydrat
zuerst von der Schwefelsäure angegriffen und in lösliche Form übergeführt würde.
Im hintern Theil der Röhre hatte auf den 16g,4 Thonkugeln eine bedeutende Anhäufung von in Wasser löslichem Kupfer
stattgefunden; die Quantität der im Wasser löslichen Schwefelsäure dagegen hatte
sich absolut von 4,24 auf 3,3 Proc. vermindert und erschien auch relativ von 1,2 auf
0,71 gesunken. Die Menge von in Wasser löslichem Fe₂O₃ war absolut
beträchtlich gewachsen, von 0,895 auf 1,70 Proc. und zeigte auch relativ eine kleine
Zunahme von 0,13 auf 0,2.
Von in Salzsäure löslichen Substanzen hatte sich die Menge Kupfer von 0,362 auf 0,46
Proc. vermehrt, eine Vermehrung, welche gegen die entsprechende im ersten Theil der
Röhre beträchtlich zurücksteht. Die Menge von SO₃ war ebenfalls von 0,687 auf
0,72 Proc. gewachsen, aber relativ von 1,5 auf 1,2 gefallen. Die Menge
Fe₂O₃ hatte sich absolut von 3,292 auf 1,6 Proc. und relativ von 3,6
auf 0,13 verringert.
Alle diese Vorgänge fassen sich nun in folgendes Bild zusammen:
Während des Zersetzungsprocesses sind im Gasstrome Schwefelsäure Kupfer und Eisen
flüchtig.
Schwefelsäure wandert am schnellsten; ihre Menge vermindert sich continuirlich gegen
das Ende der Röhre, trotzdem sie durch Einführung von Schwefelsäuredämpfen vom
Eingang her neuen Ersatz erhält.
Kupferchlorid wandert etwas langsamer und reichert die Thonkugeln gegen das Ende des
Zersetzungsapparates mit Kupfer an und hat dabei zugleich die Neigung, in eine in
Wasser unlösliche Form überzugehen.
Das Eisenchlorid verhält sich ähnlich wie das Kupferchlorid.
Das erste Experiment wurde nach der 16. Probe unterbrochen, nachdem die 23g,5 angewendeter Thonkugeln etwa 7g,5 Chlor geliefert hatten, womit man etwa
23g Chlorkalk hätte herstellen
können.
Das zweite Experiment wurde nach der 26. Probe beendigt, nachdem die dazu benützten
Thonkugeln im Gewichte von 80g,15 ungefähr
26g Chlor erzeugt hatten, mit denen man
nahezu 78g Chlorkalk hätte machen
können.
Mit dem Großbetrieb verglichen, in welchem man mit einem Zersetzungsapparat
arbeitete, der 120t Thonkugeln enthielt,
sind also beide Experimente nur so weit geführt worden, als einer Production von
etwa 120t Chlorkalk entspricht. In diesem
Stadium aber gibt ein guter Deacon'scher Apparat noch kein Zeichen einer sinkenden
Leistungsfähigkeit. Erst nach einer Production von 500t Chlorkalk fällt die Zersetzung und
verschlechtert sich nach 600t so weit, daß
ein Betrieb nicht mehr verlohnt.
Es darf daher nicht Wunder nehmen, daß die Thonkugeln am Ende des zweiten Versuches
keine Abnahme ihrer Leistungsfähigkeit zeigten. Um so klarer tritt dafür der
schädliche Einfluß hervor, welchen Schwefelsäuredampf auf den Gang des Processes
ausübt. Eine graphische Darstellung der Resultate beider Experimente macht denselben
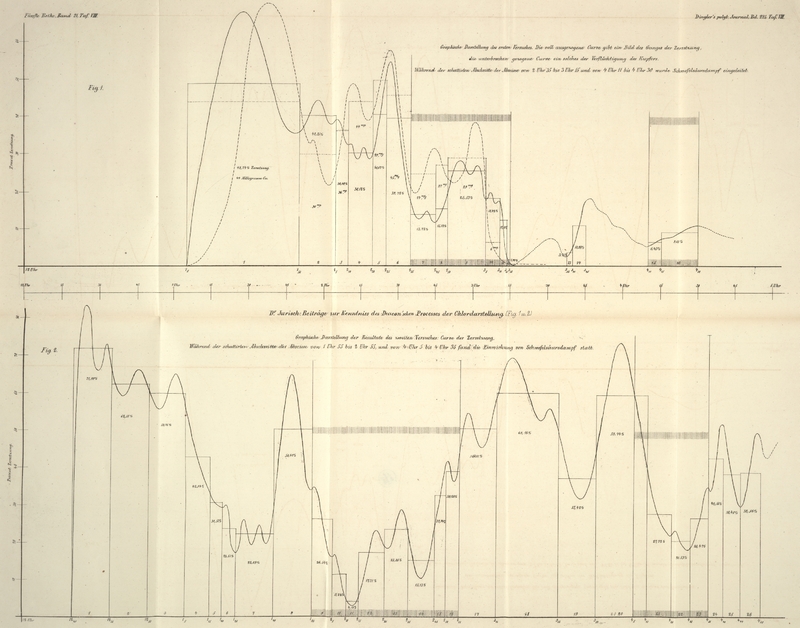
noch besonders anschaulich (vgl. Fig. 1 und 2 auf Tafel VIII).
Die Curven für die Zersetzung sind gezeichnet unter der Voraussetzung, daß dieselbe
eine continuirliche Function aller dabei mitwirkenden Veränderlichen ist, und daß
die in einer Probe gefundene Zersetzungsgröße das arithmetische Mittel ist aus allen
Zersetzungsgrößen, welche während der Dauer der Probe vorgekommen sind.
Analoge Voraussetzungen sind in Bezug auf die Curve für die Verflüchtigung des
Kupferchlorids gemacht.
Auf der Abscisse wurden die Zeiten nach einander abgetragen, welche die einzelnen
Probenahmen erforderten, und auf den zugehörigen Ordinaten die in den Proben
gefundenen Werthe.
Der erste Versuch ist durch zwei Curven (Fig. 1) dargestellt: 1) um
den Verlauf der Zersetzung, und 2) um den Verlauf der Verflüchtigung des Kupfers zu
zeigen.
Der zweite Versuch ist nur durch die Curve der Zersetzung (Fig. 2) dargestellt. Die
Curve für Verflüchtigung des Kupferchlorids fällt hier in die Abscisse, da sich kein
Kupfer verflüchtigte.
Die Curven des ersten Versuches lehren, wie nahe die Maxima der Zersetzung
zusammenfallen mit der lebhaftesten Verdampfung des Kupferchlorids; ferner wie die
Curve der Zersetzung herabsinkt, sowie Schwefelsäuredämpfe dem Gasstrome beigemengt
werden. Nach der ersten Pause zeigt die Curve wieder eine Tendenz zum Ansteigen, und
wird nach der zweiten Pause wiederum niedergedrückt durch die eingeführte
Schwefelsäure. Viel
schlagender zeigt dies jedoch die Zersetzungscurve des zweiten Versuches.
Es ist also augenscheinlich, daß die Schwefelsäure in Gasform eine chemische Action
ausübt, welche die Chlorproduction beeinträchtigt, ja welche unter besondern
Umständen dieselbe vielleicht ganz hindern mag – selbst früher, als eine
Umhüllung der Thonkugeln mit nicht activen Substanzen eine schließlich nothwendige
Unterbrechung des Processes herbeiführt.
Die richtige Erklärung der Rolle, welche die Schwefelsäure in Deacon's Proceß spielt,
mag in den Ansichten Hasenclever's und Sartori's gefunden sein.
Widnes in Lancashire, 11. Juni 1876.
Tafeln