| Titel: | Zur chemischen Technologie der Alkalien. |
| Autor: | F. |
| Fundstelle: | Band 240, Jahrgang 1881, S. 313 |
| Download: | XML |
Zur chemischen Technologie der
Alkalien.
Mit Abbildungen auf Tafel 26.
(Fortsetzung des Berichtes Seite 218 dieses
Bandes.)
Zur chemischen Technologie der Alkalien.
Ein neues Doppelsalz von Kaliummagnesiumsulfat. Als
Doppelsalz von Kaliummagnesiumsulfat ist bisher nur die Verbindung:
K2SO4,MgSO4,6H2O
genau bekannt, welche in der Mineralogie unter dem Namen Pikromorit aufgeführt, in Staſsfurt dagegen allgemein
Schönit genannt wird. Nach der Angabe von A. Frank wird dieses Doppelsalz durch einfaches
Umkrystallisiren zerlegt, wobei sich das schwer lösliche Kaliumsulfat etwa zur
Hälfte ausscheidet, während ein neues Salz von der annähernden Zusammensetzung K2SO4, 2MgSO4 in der Lösung bleibt; auch H. Schwarz (1870 189 159) nimmt an, daſs diese Zersetzung in Kaliumsulfat
und in ein an Magnesium reicheres Doppelsalz vor sich geht.
Nach Versuchen von H. Precht (Chemische Industrie, 1880 S. 419) bestehen Producte,
welche durch Umkrystallisiren von Kaliummagnesiumsulfat oder durch Zusatz von
Magnesiumsulfat aus einer Lösung von Schönit erhalten werden, aus einem Gemenge von
Schönit und Bittersalz. Precht versuchte nun,
Kaliummagnesiumsulfat in wässeriger Lösung unter Dampfdruck in Kieserit, welcher
bekanntlich als solcher in Wasser fast unlöslich, und in Kaliumsulfat zu zerlegen,
um letzteres aus einer heiſs gesättigten Lösung krystallisiren zu lassen; ferner aus
Kainit unter denselben Umständen eine sehr concentrirte Chlormagnesiumlösung
darzustellen, behufs mechanischer Trennung der dabei ungelöst bleibenden Salze
Kaliummagnesiumsulfat und Chlornatrium. Die Zersetzung schien bei 160° einzutreten
und bei 172° beendet zu sein; sie verlief aber nicht in der erwarteten Weise,
sondern nach der Gleichung: 2(K2SO4,MgSO4) = K2SO4 + K2SO4,MgSO4,H2O. Eine
Zersetzung von 3k,6 Schönit mit 5l Wasser unter einem Dampfdrucke von 8at lieferte eine nach dem Klären unter Druck
abgelassene Lauge mit 2,4 Proc. Magnesiumsulfat und 13,5 Proc. Kaliumsulfat; der
Gehalt an letzterem Salz müſste bei einer stattgefundenen Bildung von Kieserit und
Kaliumsulfat in der erhaltenen Lauge 24 Proc. betragen. Die Darstellung des neuen
Doppelsalzes aus dem Kainit hat eine technische Verwendung gefunden, da das
Kaliummagnesiumsulfat auf diesem Wege als ein feiner Schlamm erhalten wird und daher
von den Verunreinigungen des Kainits, dem Chlornatrium und Anhydrit, auf
mechanischem Wege leicht getrennt werden kann. Die Zersetzung beginnt schon bei
einem Dampfdruck von 1at; bei technischem Betriebe
steigert man jedoch den Druck zweckmäſsig auf 2 bis 4at, einer Temperatur von 120 bis 145° entsprechend, weil dadurch eine
schnellere und vollkommenere Zersetzung erzielt wird. Auf diese Weise werden
ungefähr 3t grob zerkleinerter Kainit in etwa 30 Minuten
zersetzt, wobei das Kaliummagnesiumsulfat in ein äuſserst feines Krystallmehl, das
neue Doppelsalz, übergeführt wird. Zum Aufschlieſsen dient eine für Chlornatrium
gesättigte Salzlösung, welche auch andere im Kainit vorkommende Salze enthalten
kann. Die Menge derselben wird so gewählt, daſs das Chlornatrium und das neue
Doppelsalz ungelöst bleiben, Chlorkalium und Chlormagnesium dagegen in Lösung gehen.
Die Zersetzung verläuft, unter Annahme der bisher üblichen Formel des Kainits je
nach Natur dieser Salzlösung, nach folgenden zwei Gleichungen: 3(K2SO4,MgSO4,MgCl2,6H2O) = 2(K2SO4,2MgSO4,H2O) + 2KC1 + 2MgCl2+xH2O oder 2(K2SO4,MgSO4,MgCl2,6H2O) = K2SO4,2MgSO4,H2O + 2MgCl2 + H2SO4. Nach der
ersten Gleichung verläuft die Umsetzung, wenn die Salzlösung neben Chlornatrium
Kaliummagnesiumsulfat und Chlormagnesium enthält, nach der zweiten Gleichung
vorzugsweise, wenn sie aus einer gesättigten Chlorkaliumlösung besteht. Die
Erfahrung bei fabrikmäſsigem Betriebe lehrt, daſs das neue Doppelsalz aus der
Zersetzungslauge so vollkommen gefällt wird, daſs diese beim Erkalten nur
Chlorkalium auskrystallisiren läſst und nicht mehr als 2,4 Proc. Magnesiumsulfat
enthält. Mit kaltem Wasser zerfällt es in Schönit und Bittersalz. Aus einer heiſsen,
wässerigen Lösung krystallisirt beim Erkalten Schönit, indem der Ueberschuſs an
Magnesiumsulfat gelöst bleibt. Nimmt man zum Lösen eine Chlorkaliumlösung, so findet
eine Umsetzung in Schönit und Chlormagnesium statt.
Wird Kainit mit wenig Wasser andauernd gekocht, so löst sich vorzugsweise
Chlormagnesium und Schönit wird ausgeschieden 5 bei einer gewissen Concentration
jedoch erleidet der Kainit auſserdem eine Umsetzung nach der ersten Gleichung. Ein
Versuch mit gröblich zerkleinertem chemisch reinem Kainit lieferte ein sich
ausscheidendes Salz, welches, von unzersetzten Kainitstücken getrennt, folgende
Zusammensetzung zeigte:
I.
II.
K2SO4
29,60
33,83
MgSO4
36,05
41,60
MgCl2
6,05
3,51
H2O
28,30
21,06.
Ein ähnliches Gemenge wurde beim Eindampfen einer Kainitlösung mit einer
30procentigen Chlormagnesiumlösung erhalten. Es scheint daher, daſs das neue
Doppelsalz K2Mg2(SO4)3H2O überall da gebildet wird, wo
Kaliumsulfat neben überschüssigem Magnesiumsulfat bei Siedehitze aus einer
concentrirten Chlormagnesiumlösung ausgeschieden wird.
Zur Bestimmung des Kaliumsulfates im Kainit benutzt H. Precht (Chemische
Industrie, 1881 S. 4) die Thatsache, daſs der Kainit in den Bergwerken nur
mit wechselnden Mengen von Steinsalz verunreinigt ist, der Gehalt der übrigen in
geringen Mengen auftretenden Gemengtheile von Anhydrit und Thon in verschiedenen
Schichten gleich bleibt.Da nun der Chlorgehalt im Kainit der Formel K2SO4,MgSO4,MgCl2,6H2O entsprechend 14,28 Proc. und im Steinsalz 60,61 Proc. beträgt, so kann
man auf Grund dieses Unterschiedes aus einer Chlorbestimmung den Gehalt an
Kaliumsulfat hinreichend genau ermitteln, indem der Zunahme von 1 Proc. Chlor eine
Abnahme von 0,76 Proc. Kaliumsulfat und eine Zunahme von 2,16 Proc. Chlornatrium
entspricht.
Bei der Ausführung dieser Methode werden 10g fein
gemahlener Kainit in 500cc Wasser gelöst, ohne zu
filtriren, 20cc mit Zehntel-Silberlösung titrirt.
Es entspricht dann:
Silberlösung
Kaliumsulfat
Chlornatrium
24,0cc
29,33 Proc.
15,17 Proc.
25,0
28,67
17,08
26,0
27,89
19,00
27,0
27,21
21,09
28,0
26,55
22,80
29,0
25,87
24,68
30,0
25,11
26,60
31,0
24,53
28,63
32,0
23,84
30,54
33,0
23,18
32,40
34,0
22,52
34,32.
Um ein Bleikammersystem ins Freie
arbeiten zu lassen, brachte H. Riemann in das
Verbindungsrohr zwischen Gloverthurm und Bleikammer ein von Gebrüder Körting in Hannover aus Blei hergestelltes Dampfstrahlgebläse an. Dasselbe bewährt sich
vortrefflich und ist überall da zu empfehlen, wo aus irgend welchem Grunde in den
Kiesöfen mangelhafter Zug vorhanden ist.
Durch Einwirkung von concentrirter
Schwefelsäure auf Blei bei gewöhnlicher Temperatur wird nach J. Napier und R. R.
Tatlock (Chemical News, 1880 Bd. 42 S. 314)
Wasserstoffgas entwickelt. Schwefelsäure, welche nur 0,02 Proc. Schwefligsäure,
0,013 Proc. schwefelsaures Blei und 0,07 Proc. schwefelsaures Calcium enthielt und
1,842 sp. G. hatte, wurde in Kästen aus starken Bleiplatten versendet, welche durch
den entwickelten Wasserstoff kugelförmig aufgeblasen wurden. Das verwendete Blei
enthielt nur Spuren von Kupfer und Eisen, war aber sonst sehr rein.
Im Anschluſs an die Versuche von Wright (Wagners Jahresbericht, 1867 S. 186)
und Scheurer-Kestner (1872 206 377) suchten W. Smith und T. Liddle,
wie in Chemical News, 1880 Bd. 42 S. 244 berichtet
wird, die Beschaffenheit des in dem beim Kausticiren von
Soda erhaltenen Schlamme zurückgehaltenen Natrons festzustellen (vgl. Jurisch 1881 239 395). Es wurde eine Natronlösung mit
6,52 Proc. Na2O und von 1,09 sp. G. mit frisch
gefälltem kohlensaurem Calcium gekocht. Der erhaltene Rückstand enthielt nach dem
Abwaschen kein Natron. Ebenso wenig nahm fein gepulverter Marmor Natron auf, auch
nicht beim Kochen mit einer Sodalösung. Als aber eine Sodalösung mit Aetzkalk gekocht wurde, enthielt
der mit heiſsem Wasser gewaschene Rückstand 1,28 Proc. Natron; beim Kochen von
Kalkmilch mit Natronlösung enthielt der Rückstand 0,05 Proc., anscheinend weil die
Lauge etwas Kohlensäure angezogen hatte. Als die Sodalösung mit der 3fachen Menge
Kalkwasser zum Sieden erhitzt wurde, schied sich ein flockiger, bald krystallinisch
werdender Niederschlag ab, welcher 67,9 Proc. kohlensaures Calcium und 2,46 Proc.
kohlensaures Natrium enthielt.
Ein krystallisirtes Doppelsulfat von
Calcium und Natrium, CaNa2(SO4)2, scheidet sich
nach Ch. W. Folkard (Chemical
News, 1881 Bd. 43 S. 6) in Glimmer ähnlichen Blättchen ab beim Verdampfen
der durch Umsetzung von essigsaurem Calcium mit schwefelsaurem Natrium erhaltenen
Lösung von essigsaurem Natrium. Die Verbindung ist unlöslich in concentrirten
Lösungen von essigsaurem Natrium, wird aber in verdünnten Lösungen und durch reines
Wasser zersetzt. Beim Verdampfen einer Weinsäurelösung erhielt G. H. Ogston die entsprechende Kaliumverbindung CaK2(SO4)2. ½ aq.
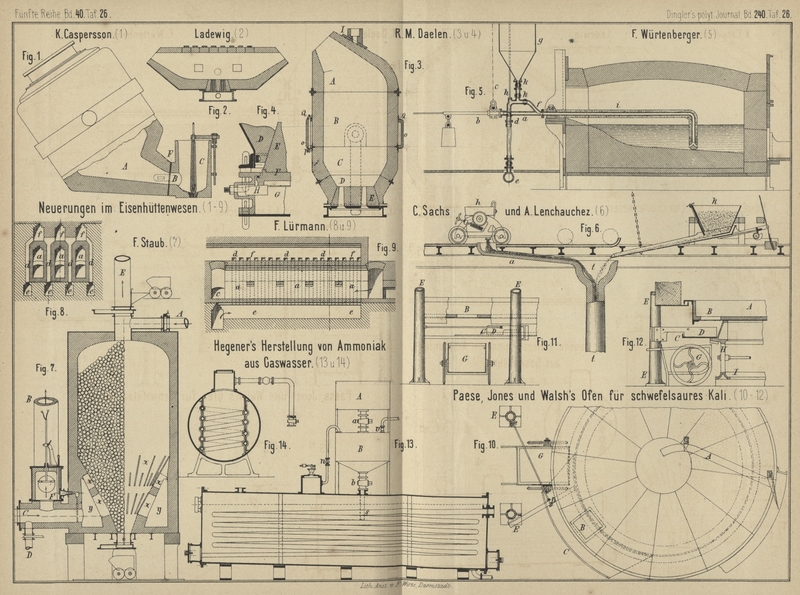
Bei den rotirenden Oefen und Pfannen zur
Darstellung von schwefelsaurem Kali und Natron (1879 231 * 153) von H. F. Pease, W. Jones und J. Walsh in Middlesbrough (*
D. R. P. Kl. 75 Zusatz Nr. 11953 vom 18. April 1880) liegt über der Ofensohle der
Rührer A (Fig. 10 bis
12 Taf. 26), welcher während der Arbeit in den Inhalt des Ofens taucht
und in dem Winkel von 35° gegen den Horizont festgehalten wird. Am Boden der Pfanne,
nächst ihrem äuſseren Rande, befindet sich ein oder mehrere Löcher B, welche so lange geschlossen gehalten werden, bis der
Inhalt abgezogen werden kann. Unmittelbar unter den Löchern B befindet sich ein Brett C, welches an der
Pfanne befestigt ist und sich mit derselben dreht. Um den Inhalt der Pfanne
abzuziehen, halt man mit der Drehung der Pfanne ein und öffnet die Klappe B, so daſs die Masse auf das Brett C fällt. Nun wird die Pfanne wieder in Bewegung
versetzt und, da der Inhalt durch den Rührer A
aufgehalten wird, so fällt etwa eine Schiebkarrenladung heraus, um vom Brett C durch Handarbeit in den untergestellten Schiebkarren
G gekratzt zu werden. Um die Masse vom Brett C durch die Maschine selbst zu entfernen, ist ein
Abstreichmesser D (Fig. 11 und
12) auſserhalb der rotirenden Pfanne an den Ständern oder Säulen E aufgehängt, welches bei weiterer Drehung der Pfanne
die auf C liegende Masse herabrückt und in den
Schiebkarren wirft. Statt des Brettes C kann man auch
unter den Löchern B einen Behälter anbringen, der die
fragliche Ladung zu fassen vermag. Dieser Behälter hat eine Bodenklappe mit einer
Federklinke, durch welche, wenn der Inhalt des Behälters sich in den Schiebkarren
entleert hat, die Klappe während der Drehung der Pfanne mittels der Räder H auf den Schienen I
wieder eingeklinkt wird.
Apparat zur Entwicklung von Ammoniak aus Gaswässern von
A. Hegener in Köln (* D. R. P. Kl. 75 Nr. 11669 vom
11. März 1880). Der Kessel (Fig. 13 und
14 Taf. 26) wird mit Ammoniakwasser gefüllt und das letztere durch eine
mit Dampf geheizte Schlange bis zum Siedepunkt erwärmt, so daſs das freie und an
Kohlensäure gebundene Ammoniak durch die Wärme ausgetrieben wird. Um nun noch die
zurückbleibenden Ammoniakverbindungen zu zersetzen, sind über dem Kessel zwei über
einander liegende Behälter aufgestellt. In dem oberen A
wird Kalk gelöscht; der untere B ist geschlossen und
steht mit dem oberen durch einen Hahn a in Verbindung.
Der Lufthahn v auf dem unteren Behälter dient dazu, die
in letzteren eindringenden Ammoniakgase nach einer bestimmten Stelle durch ein Rohr
abzuleiten, wenn man die Kalkmilch aus A einflieſsen
läſst. Soll nun die Kalkmilch in den Kessel gefüllt werden, so werden die Hähne a und v geschlossen, der
Dampfhahn n und der Hahn b
geöffnet, so daſs die Kalkmilch durch das bis unter den Flüssigkeitsspiegel des
Kessels reichende Speiserohr s in den Kessel
einflieſst.
Um das im Gaswasser enthaltene Schwefelammonium in schwefelsaures Ammonium überzuführen, will Joung (Englisches Patent Nr. 1310 vom 30. März 1880)
die Destillationsproducte mit atmosphärischer Luft gemischt über eine Feuerung
hinweg zu den Condensationsgefäſsen leiten. – Da hierbei nicht nur der Schwefel zu
Schwefligsäure und Schwefelsäure verbrennt, sondern auch Ammoniak zerstört wird, so
ist dieser Vorschlag nicht empfehlenswerth.
Zur synthetischen Herstellung von
Ammoniak aus dem Stickstoff der atmosphärischen Luft (vgl. 1880 236 * 47.
238 * 481) wollen W. Müller in Antwerpen und E. Geisenberger in Brüssel (* D. R. P. Nr. 11489 vom
19. Juni 1879) Feuergase mittels Kalk von Kohlensäure befreien, ferner über glühende
Kokes Wasserdampf leiten und den so erhaltenen Wasserstoff mit dem Stickstoff
mittels durchschlagender elektrischer Funken zu Ammoniak verbinden. Nach einem
zweiten Vorschlage (* D. R. P. Nr. 12364 vom 17. Juni 1880) sollen die durch
Erhitzen von alkalischen Nitraten erhaltenen gasförmigen Zersetzungsproducte mit
Wasserdampf über glühende Kohlen geleitet werden. Der alkalische Rückstand wird
durch Einwirkung von Sauerstoff und Stickstoff unter dem Einfluſs des elektrischen
Stromes wieder in das ursprüngliche Salz zurückverwandelt.
N. Basset in Paris (Englisches Patent Nr. 4338 vom 24.
October 1879) will mit Borsäure getränkte Kohle mit einer Schicht Magnesia, Kalk,
Manganoxyd u. dgl. bedeckt in einer Retorte erhitzen und über das Gemisch Stickstoff
leiten. Hat sich eine genügende Menge Stickstoffbor gebildet, so wird Wasserdampf
eingeleitet und das gebildete Ammoniak abgeführt.
F.
Tafeln